【高考化学·考试大纲】能利用电离平衡常数进行相关计算。
【课程标准·学业要求】(1)能从电离、离子反应、化学平衡的角度分析溶液的性质,如酸碱性、导电性等。(2)能综合运用离子反应、化学平衡原理,分析和解决生产、生活中有关电解质溶液的实际问题。
1.下列判断正确的是( )
A.[16 全国Ⅰ,12]已知0.10mol/L氨水的电离度为1.32%,则溶液的pH<12
B.[14 全国Ⅱ,11]pH=5的H2S溶液中,c(H+)=c(HS-)=1×10-5mol·L-1
2.[16 全国Ⅲ,13]下列说法正确的是( )
A.向0.1mol·L-1CH3COOH溶液中加入少量水,溶液中![]() 减小
减小
B.将CH3COONa溶液从20℃升温至30℃,溶液中![]() 增大
增大
C.向盐酸中加入氨水至中性,溶液中![]()
D.向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中![]() 不变
不变
★1.外界条件对弱电解质电离和盐水解的影响
一、电离平衡常数
1.表示
一元弱酸HA:![]()
一元弱碱BOH:![]()
2.特点
(1)电离平衡常数只与温度有关,升温,K值增大。
(2)多元弱酸的各级电离平衡常数的大小关系是Ka1≫Ka2≫Ka3,所以其酸性主要取决于第一级电离。所以,在H2CO3溶液中,c(H2CO3)≫c(HCO-3)≫c(CO2-3)。
3.几种分子的酸性(活性氢)强弱的比较
H2SO3>CH3COOH>H2CO3>C6H5OH>HCO-3>H2O>C2H5OH。
4.意义
【考型1】条件改变时,微粒浓度比值的变化
1.判断正误:
(1)[江苏高考]CH3COOH溶液加水稀释后,溶液中![]() 的值减小。( )
的值减小。( )
(2)[安徽高考]向0.1mol·L-1的NaHSO3溶液中,加入少量NaOH溶液![]() 的值均增大。( )
的值均增大。( )
【考型2】多元弱酸反应中的“强制弱”
2.[15 福建,23]25℃,两种酸的电离平衡常数如下表
(1)HSO-3的电离平衡常数表达式:K=;
(2)H2SO3溶液和NaHCO3溶液反应的主要离子方程式为_____________________________。
【考型3】平衡常数及其计算
3-1.[17 天津,10]已知25℃,NH3·H2O的Kb=1.8×10-5,H2SO3的Ka1=1.3×10-2,Ka2=6.2×10-8。
(1)若氨水的浓度为2.0mol·L-1,溶液中的c(OH-)=_______mol·L-1.
(2)将SO2通入该氨水中,当c(OH-)降至1.0×10-7mol·L-1时,溶液中的![]() (https://www.xing528.com)
(https://www.xing528.com)
3-2.[15上海,31]室温下,0.1mol/L NaClO溶液的pH_______0.1mol/L Na2SO3溶液的pH(选填“大于”、“小于”或“等于”)。浓度均为0.1mol/L的Na2SO3和Na2CO3的混合溶液中,SO2-3、CO2-3、HSO-3、HCO-3浓度从大到小的顺序为_______________________。
已知:H2SO3:Ka1=1.54×10-2、Ka2=1.02×10-7;HClO:Ka1=2.95×10-8;H2CO3:Ka1=4.3×10-7、Ka2=5.6×10-11。
【考型4】电离平衡常数与水解平衡常数的关系
4.[16 全国Ⅱ,26]联氨为二元弱碱,在水中的电离方程式与氨相似,联氨第一步电离反应的平衡常数值为_________________。(已知:N2H4+H+ N2H5+的K=8.7×107;Kw=1.0×10-14)
N2H5+的K=8.7×107;Kw=1.0×10-14)
一、条件改变时,微粒浓度比值的变化
(1)直接分析条件变化后,分子与分母的增大或减小对值的影响,得出结论。
(2)由于在同一溶液中进行,浓度之比等于物质的量之比,转变成物质的量后分析。
(3)补充成含平衡常数的表示式,使其转变成单一浓度变量进行分析。
二、电离平衡常数的简单讨论
1.弱酸浓度与H+浓度的关系
设一元弱酸的物质的量浓度为c,电离度为α,若忽略水的电离,一般1≫α,1-α≈1,
(1)已知c(HAc)和Ka,求c(H+)或pH值。
求25℃,0.1mol/L醋酸溶液的c(H+)(已知:醋酸Ka=1.75×10-5)。
(2)已知c(HAc)和c(H+)或pH,求Ka。
已知25℃,0.1mol/L醋酸溶液的pH值为3,求醋酸的电离平衡常数Ka。
2.*几个定性结论的定量分析(以醋酸为例分析)
结论1:弱酸的电离度通常小于10%。电离度
结论2:弱酸稀释100倍,pH增大小于2个单位(约为1个单位),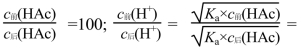

结论3:c(酸)浓度越大,电离度α越小,![]()
二、电离平衡常数与水解平衡常数的关系
(1)电离平衡常数:Ka(HX)>Ka(HY)>Ka(HZ);相同浓度的溶液pH:HX<HY<HZ
弱酸的电离平衡常数与其水解平衡常数的依存关系
其相互关系为:Kw=Kh·Ka,由此可知,越弱越水解。
电离常数:Ka(HX)>Ka(HY)>Ka(HZ);则水解程度:Kh(NaX)<Kh(NaY)<Kh(NaZ)。
(2)电离常数与水解常数的关系(以H2C2O4为例):
①多元弱酸与多元弱酸根Ka1(H2C2O4)>Ka2(HC2O-4);在H2C2O4溶液中,c(H2C2O4)>c(HC2O-4)>c(C2O2-4)
②H2C2O4![]()
Kw=Kh2·Ka1;Kw=Kh1·Ka2。
(3)讨论反应进行的方向——强制弱:
①)当Ka(HX)>Ka(HY):HX+NaY=NaX+HY
②由于Ka1(H2C2O4)>Ka2(HC2O-4):H2C2O4+C2O2-4==2HC2O-4
(4)在溶液中的所有平衡是同时的。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




