1.[18 全国Ⅱ,27]CH4-CO2催化重整反应中,催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。相关数据如下表:
(1)由上表判断,催化剂X____Y(填“优于”或“劣于”),理由是_____________________________________________________________________________________。在反应进料气组成、压强及反应时间相同的情况下,某催化剂表面的积碳量随温度的变化关系如图1所示。升高温度时,下列关于积碳反应、消碳反应的平衡常数(K)和速率(v)的叙述正确的是( )。
图1
图2
A.K积、K消均增加
B.v积减小,v消增加
C.K积减小,K消增加
D.v消增加的倍数比v积增加的倍数大
(2)在一定温度下,测得某催化剂上沉积碳的生成速率方程式为v=k·p(CH4)·[p(CO2)]-0.5(k为速率常数)。在p(CH4)一定时,不同p(CO2)下积碳量随时间的变化趋势如图2所示,则pa(CO2)、pb(CO2)、pc(CO2)从大到小的顺序为_______。
2.[18 全国Ⅲ,28]对于反应2SiHCl3(g)==SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323K和343K时SiHCl3的转化率随时间变化的结果如图所示。
(1)343K时反应的平衡转化率α=_________%。平衡常数K343K=__________(保留2位小数)。
(2)在343K下,要提高SiHCl3转化率,可采取的措施是________________;要缩短反应达到平衡的时间,可采取的措施有_____________________、_____________________________________。
(3)比较a、b处反应速率大小:υa_____υb(填“大于”“小于”或“等于”)。反应速率υ=υ正−υ逆=k正x2SiHCl3−k逆xSiH2Cl2xSiHCl4,k正、k逆分别为正逆向反应速率常数,x为物质的量分数,计算![]() ______(保留1位小数)。
______(保留1位小数)。
3.[15 全国Ⅰ,28]Bodensteins研究了下列反应:2HI(g) H2(g)+I2(g)在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
H2(g)+I2(g)在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
(1)根据上述实验结果,该反应的平衡常数K的计算式为。
(2)上述反应中,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)x(I2),其中k正、k逆为速率常数,则k逆为(以K和k正表示)。若k正=0.0027min-1,在t=40min时,v正=min-1
(3)由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用下图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为(填字母)
1.气体的分压P(i)
在容器内的混合气体,每一种气体都均匀地分布在整个容器内,它所产生的压强和它单独占有容器的压强相同。
由PV=nRT可知![]()
所以,气体的分压与气体的物质的量浓度性质相似,且成正比。
2.用气体分压表示化学平衡常数
对有气体参与的可逆反应,在恒温恒压下进行,其平衡常数常用分压来表示:aA(g)+bB(g) cC(g)+dD(g)
cC(g)+dD(g)
【考型1】以等效为参照分析转化率
1-1.判断下列正误。
(1)[四川高考]在一定温度下,将气体X和气体Y各0.16mol充入恒容密闭容器中,发生反应X(g)+Y(g) 2Z(g) ΔH<0,平衡时,其他条件不变,再充入0.2molZ,新平衡时X的体积分数增大。( )
2Z(g) ΔH<0,平衡时,其他条件不变,再充入0.2molZ,新平衡时X的体积分数增大。( )
(2)[江苏高考]温度为T时,向2.0L恒容密闭容器中充入1.0molPCl5,反应PCl5(g) PCl3(g)+Cl2(g),测得平衡时n(PCl3)为0.20mol,相同温度下,起始时向容器中充入2.0molPCl3和2.0molCl2,达到平衡时,PCl3的转化率小于80%。( )
PCl3(g)+Cl2(g),测得平衡时n(PCl3)为0.20mol,相同温度下,起始时向容器中充入2.0molPCl3和2.0molCl2,达到平衡时,PCl3的转化率小于80%。( )
1-2.[14 江苏,15]一定温度下,在三个体积均为1.0L的恒容密闭容器中发生反应:2CH3OH(g) CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
下列说法正确的是[双选]( )
A.该反应的正反应为放热反应
B.达到平衡时,容器Ⅰ中的CH3OH体积分数比容器Ⅱ中的小
C.容器Ⅰ中反应到达平衡所需时间比容器Ⅲ中的长
D.若起始时向容器Ⅰ中充入CH3OH0.15mol、CH3OCH30.15mol和H2O0.10mol,则反应将向正反应方向进行
【考型2】用气体的分压来分析化学平衡
2.[全国高考Ⅱ]在1.0L密闭容器中放入0.10mol
A(g),在一定温度进行如下反应:
A(g) B(g)+C(g) ΔH=+85.1kJ·mol-1
B(g)+C(g) ΔH=+85.1kJ·mol-1
反应时间(t)与容器内气体总压强(p)的数据见下表:
(1)欲提高A的平衡转化率,应采取的措施为_____________________________________。
(2)由总压强p和起始压强p0计算反应物A的转化率α(A)的表达式为____________,平衡时A的转化率为________,列式并计算反应的平衡常数K______________________________________________________________________________。
(3)①由总压强p和起始压强p0表示反应体系的总物质的量n总和反应物A的物质的量n(A),n总=________mol,n(A)=________mol。(https://www.xing528.com)
【考型3】速率公式与化学平衡的联系
3.[18 全国I,28]F.Daniels等曾利用测压法在刚性反应器中研究了25℃时N2O5(g)分解反应:
其中NO2二聚为N2O4的反应可以迅速达到平衡。体系的总压强p随时间t的变化如下表所示(t=∞时,N2O5(g)完全分解):
(1)已知:2N2O5(g)==2N2O4(g)+O2(g) ΔH1=-4.4kJ·mol-1
2NO2(g)==N2O4(g) ΔH2=-55.3kJ·mol-1
则反应N2O5(g)=2NO2(g)+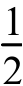 O2(g)的ΔH=____kJ·mol-1
O2(g)的ΔH=____kJ·mol-1
(2)研究表明,N2O5(g)分解的反应速率v=2×10-3×pN2O5(kPa·min-1),t=62min时,测得体系中pO2=2.9kPa,则此时的pN2O5=_____kPa,v=_____kPa·min-1。
(3)若提高反应温度至35℃,则N2O5(g)完全分解后体系压强p∞(35℃)____63.1kPa(填“大于”“等于”或“小于”),原因是_________________________________________________________________________________。
(4)25℃时N2O4(g) 2NO2(g)反应的平衡常数Kp=_______________kPa(Kp为以分压表示的平衡常数,计算结果保留1位小数)。
2NO2(g)反应的平衡常数Kp=_______________kPa(Kp为以分压表示的平衡常数,计算结果保留1位小数)。
【考型4】*半衰期规律在反应速率中的运用
4.[13 全国Ⅱ,28]下表为反应物A浓度与反应时间的数据,计算:a=________。
分析该反应中反应物的浓度c(A)变化与时间间隔(Δt)的规律,得出的结论是_______________________________________________________。
由此规律推出反应在12h时反应物的浓度c(A)为_______mol·L-1。
一、以等效平衡为参照分析转化率的变化
(1)先假设一个外界条件,与对照实验建立起等效平衡,这时转化率相同。
(2)再将假设条件,转变为题设条件,分析平衡移动的方向,确定转化率的变化。
(3)常见的几种情况:
①恒温恒容条件下的转化率变化:先假设在“恒温恒压”条件下,等比例加入物质→与原平衡建立为等效平衡→再把“恒压”转变成“恒容”→分析平衡移动方向→确定转化率的增减。
②加减量法研究不等效平衡:先设按一定的“加入量”→与原平衡建立为等效平衡→再把这个“加入量”转变成实验加入量→分析平衡移动方向→确定转化率的增减。
③分析物质的范围:因为可逆反应不能进行到底,通常采用以正反应开始和以逆反应开始的两种极端情况来取值,从而得出范围。
二、用气体的分压来表示的化学平衡常数
一般对气体参加的反应,在恒容条件下,由于反应前后体积不变,用c(B)表示比较方便,此时,常用K表示平衡常数;但在恒压条件下,对于气体分子数改变的反应,反应后体积变化,c(B)会因体积变化而受到影响,这时,用分压来表示比较简单。
①气体的总压等于分组的各气体的分压之和。
P(总)=p(A)+p(B)+p(C)+p(D)+……
②在同一体系中,分压与其它量的关系
所以,在有关化学平衡的计算中,和物质的量,或物质的量浓度一样,也可以用气体的分压来进行对应的有关计算:p(i)=P(总)·X(i)。
三、★速率公式与化学平衡的联系
1.化学反应中的三种速率表示
正反应速率v正,逆反应速率v逆,净反应速率v=v正-v逆
速率公式通常通过实验测得的,试题中,v正,v逆。常用基元反应的速率公式来简单表示。
如:2HI(g) H2(g)+I2(g)
H2(g)+I2(g)
v正=K正c2(HI),v逆=K逆c(H2)·c(I2);其中K正、K逆为速率常数。v正只与反应物浓度有关,v逆只与生成物浓度有关,但是可以用任何一种浓度的变化来表示;速率常数K正、K逆表示反应进行的快慢,受温度影响,一般认为,温度越高K正、k逆越大。
2.速率公式对化学平衡移动的判断
(1)判断反应进行的方向。
当v正>v逆,反应向正反应方向进行;当v正<v逆,反应向逆反应方向进行;当v正=v逆,反应达化学平衡状态。
(2)与化学平衡的性质联系,考查化学核心素养中的证据推理平衡时,v正=v逆,联系两个表达式,进行推理计算,例如:如:2HI(g) H2(g)+I2(g)
H2(g)+I2(g)
①得出平衡常数的值和表达式;②讨论速率常数K正、K逆与相关性质,升高温度,K正、k逆增加的倍数与反应热(ΔH)有关;③进行相关的定量计算。
四、*半衰期规律在反应速率中的体现
半衰期规律:每间隔一个相同的时间,反应物浓度减少一半(或生成物浓度增加一倍)。这个时间称为半衰时间。
反应物浓度减少一半所需要的时间叫半衰期。设半衰时间为a,则不同时间的浓度变化有如下公式:![]() Δt表示时间变化(t-t0),a为半衰时间。
Δt表示时间变化(t-t0),a为半衰时间。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




