【高考化学·考试大纲】(1)了解化学反应的可逆性及化学平衡的建立。(2)掌握化学平衡的特征。了解化学平衡常数(K)的含义,能利用化学平衡常数进行相关计算。(3)理解外界条件(浓度、温度、压强、催化剂等)对反应速率和化学平衡的影响,能用相关理论解释其一般规律。(4)了解化学反应速率和化学平衡的调控在生活、生产和科学研究领域中的重要作用。
【课程标准·学业要求】(1)能运用浓度、压强、温度对化学平衡的影响规律,推测平衡移动方向及浓度、转化率等相关物理量的变化。(2)能讨论化学反应条件的选择和优化。
1.[18 全国Ⅱ,27]CH4-CO2催化重整反应为:CH4(g)+CO2(g)==2CO(g)+2H2(g) ΔH=+247kJ·mol-1。有利于提高CH4平衡转化率的条件是( )
A.高温低压 B.低温高压 C.高温高压 D.低温低压
2.[17 全国Ⅰ,28]H2S与CO2在高温下发生反应:H2S(g)+CO2(g) COS(g)+H2O(g)。反应平衡后向反应器中再分别充入下列气体,能使H2S转化率增大的是( )
COS(g)+H2O(g)。反应平衡后向反应器中再分别充入下列气体,能使H2S转化率增大的是( )
A.H2S B.CO2 C.COS D.N2
3.[16 全国Ⅱ,27]以丙烯、氨、氧气为原料,在催化剂存在下生成丙烯腈(C3H3N)和副产物丙烯醛(C3H4O)的热化学方程式如下:
①C3H6(g)+NH3(g)+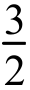 O2(g)
O2(g) C3H3N(g)+3H2O(g)
C3H3N(g)+3H2O(g)
ΔH=-515kJ/mol
②C3H6(g)+O2(g) C3H4O(g)+H2O(g)
C3H4O(g)+H2O(g)
ΔH=-353kJ/mol
两个反应在热力学上趋势均很大,其原因是_______________________________________;
有利于提高丙烯腈平衡产率的反应条件是______________________________________。
4.[17 全国Ⅱ,27]正丁烷脱氢制丁烯的热化学方程式:C4H10(g)==C4H8(g)+H2(g) ΔH==123kJ·mol-1;下图是该反应的平衡转化率与反应温度及压强的关系图,x____0.1(填“大于”或“小于”)欲使丁烯的平衡产率提高,应采取的措施是( )
A.升高温度 B.降低温度 C.增大压强 D.降低压强
5.[17 全国Ⅲ,28]298K时,发生反应:AsO33-(aq)+I2(aq)+2OH-(aq) AsO43-(aq)+2I-(aq)+H2O(l)溶液中c(AsO43-)与反应时间(t)的关系如图所示。
AsO43-(aq)+2I-(aq)+H2O(l)溶液中c(AsO43-)与反应时间(t)的关系如图所示。
(1)tm时,v正_____v逆(填“大于”、“小于”或“等于”)。
(2)tm时v逆____tn时v逆(填“同上”),理由是______________________________________。
化学平衡的移动原理——勒夏特列原理
1.如果改变影响平衡的一个条件(如____、____或____),平衡就向着能够___这种改变的方向移动。
2.★外界条件对化学平衡移动和相对速率大小的影响
常见的可逆反应中的热效应:
(1)2NO2(g)(红棕色) N2O4(g)(无色) ΔH<0
N2O4(g)(无色) ΔH<0
(2)N2+3H2![]()
3.反应速率的变化趋势
(1)随着反应的进行,反应的浓度通常越来越小,反应速率将会越来越慢。
(2)在时间—浓度图中,反应速率越快,曲线斜率越大。
(3)通常所说的化学反应速率v(B)常为净反应速率,即v(B)=|v正(B)-v逆(B)|。
(4)反应物的浓度只影响正反应速率,生成物的浓度只影响逆反应速率。
【考型1】正逆反应的相对速率与化学平衡移动的方向
1.[重庆高考](1)工业上尿素[CO(NH2)2]由CO2和NH3在一定条件下合成,其反应方程式为_________________________________。
(2)当氨碳比![]() =4时,CO2的转化率随时间的变化关系如右图所示。A点的逆反应速率v逆(CO2)__________B点的正反应速率v正(CO2)(填“大于”、“小于”或“等于”)。
=4时,CO2的转化率随时间的变化关系如右图所示。A点的逆反应速率v逆(CO2)__________B点的正反应速率v正(CO2)(填“大于”、“小于”或“等于”)。
【考型2】外界条件对化学反应平衡的影响
2.[16 天津,10][双选]在恒温恒容的密闭容器中,某储氢反应:MHx(s)+yH2(g) MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是( )(https://www.xing528.com)
MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是( )(https://www.xing528.com)
A.容器内气体压强保持不变
B.吸收ymolH2只需1molMHx
C.若降温,该反应的平衡常数增大
D.若向容器内通入少量氢气,则v(放氢)>v(吸氢)
【考型3】稀有气体对化学平衡的影响
3.[15 浙江,28]乙苯催化脱氢制苯乙烯反应:![]() 工业上,通常在乙苯蒸气中掺混水蒸气,并保持体系总压为常压的条件下进行反应。掺混水蒸气提高乙苯的平衡转化率,解释说明该事实___________________________________________________________。
工业上,通常在乙苯蒸气中掺混水蒸气,并保持体系总压为常压的条件下进行反应。掺混水蒸气提高乙苯的平衡转化率,解释说明该事实___________________________________________________________。
【考型4】温度对化学反应速率和平衡的影响
4.[福建高考]已知:H2S(g) H2(g)+1/2S2(g),在恒温密闭容器中,控制不同温度进行H2S分解实验。以H2S起始浓度均为cmol·L-1测定H2S的转化率,结果见下图。图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率。说明温度升高,曲线b向曲线a逼近的原因:_____________________________________________________________________________。
H2(g)+1/2S2(g),在恒温密闭容器中,控制不同温度进行H2S分解实验。以H2S起始浓度均为cmol·L-1测定H2S的转化率,结果见下图。图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率。说明温度升高,曲线b向曲线a逼近的原因:_____________________________________________________________________________。
一、外界条件对化学平衡的影响
1.影响条件
研究化学平衡时,要特别注意抓“两类条件和反应的三大特点”。
两类外界条件是:“恒温恒压、恒温恒容”。
反应的三大特点:
★区分:外界条件对化学平衡的影响和对反应速率的影响是不同的,不能混淆。正反应速率加快,化学平衡不一定向正反应方向移动;化学平衡的移动方向是由正逆反应速率的相对大小决定的,谁大向谁的方向移动;平衡向正反应方向移动,物质的转化率也不一定增加。
2.v(正)和v(逆)相对大小决定反应进行的方向
当v(正)>v(逆)时,反应朝正反应方向进行,达到平衡时:v(正)>v平(正)=v平(逆)>v(逆)。
当v(正)<v(逆)时,反应朝逆反应方向进行,达到平衡时:v(正)<v平(正)=v平(逆)<v(逆)。
3.温度对化学平衡移动的快捷判断
温度改变化学平衡一定移动!升高温度,向吸热反应方向移动。快捷判断法:升高温度,化学平衡向ΔH与0比较的不等号“指向”的方向移动;即T↗时,当ΔH>0时,化学平衡正向(→)移动;当ΔH<0时,化学平衡←移动。
4.化学平衡不能进行到底
平衡时各物质的量均不能为零,这通常成为用极端思维法来确定物质的量取值范围的依据。
5.增加纯固体或纯液体物质的量平衡不移动
二、惰性气体(不参与反应的气体)对化学平衡的影响
由表小结:恒压等于减压分析,恒容等于不移动。
这种分析思想,可用于对弱电解质溶液加水稀释的解释,当对弱电解质加水稀释时(相当于在恒压条件下加入稀有气体),电离平衡向电离的方向移动(微粒数增大的方向)。
三、★转化率(或反应速率)出现峰值的讨论
1.在速率-浓度图中,当在开始的一段时间内,反应速率逐渐增加的可能原因
(1)生成了催化剂,对反应有催化作用;(2)反应形成了原电池;(3)放热反应,由于自身放出的热量使反应温度升高,促进了反应速率的加快;这是在新高考中出现的特殊情况。
2.放热绝热体系的分析
对于恒容绝热容器(不与外界交换能量)或持续加热的放热反应(ΔH<0),每隔一段时间,测反应的转化率,其变化如下图:
分析时,抓住反应中温度在不断地增加,且是经过相同的时间段进行测定,决定前后两段变化的主要因素不同:①开始一段时间,未达到化学平衡,升高温度反应速率加快,转化率增加。②一段时间反应达到化学平衡,升高温度平衡移动向吸热方向移动,转化率降低。
四、能用化学平衡原理解释的反应与现象
①可逆反应。②弱电解质有关的反应。③离子的水解反应。④沉淀溶解与生成。⑤氨气的溶解与逸出等。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




