【高考化学·考试大纲】(1)掌握元素周期律的实质。了解元素周期表(长式)的结构(周期、族)及其应用。(2)了解化学键的定义。了解离子键、共价键的形成。
【课程标准·学业要求】能判断简单离子化合物和共价化合物中的化学键类型。
●化学键与物质的性质
1.下列叙述不正确的是( )
A.[18 全国I,12]常温常压下Na的单质为气态
B.[18 全国I,12]Ca的氢化物为离子化合物
C.[18 全国Ⅱ,10]O与N,Na,Cl三种元素均可形成两种或两种以上的二元化合物
D.[15 全国Ⅱ,9]K和S、Cl、H三种元素均能形成离子化合物
2.下列叙述正确的是( )
A.[18 全国Ⅱ,10]Na与N、O、Cl三种元素分别形成的化合物中只含有离子键
B.[18 全国Ⅲ,13]Na2O2与ClO2均含有非极性共价键
C.[18 全国Ⅲ,13]标准状况下O的单质状态与F的相同
3.[双选]下列关系正确的是( )
A.[17 全国Ⅲ,12]氢化物沸点:N<Cl
B.[17 全国Ⅲ,12]化合物熔点:Al2O3<AlCl3
C.[17 全国Ⅰ,12]钠的简单离子与氧的具有相同的电子层结构
D.[15 全国Ⅰ,12]单质的沸点:H>N
●周期表与元素推断
4.[17 全国Ⅲ,12]短周期元素W、X、Y和Z在周期表中的相对位置如下表所示,这四种元素原子的最外电子数之和为21。
则:W____、X____、Y___、Z___(填元素符号)。
5.[16 全国Ⅰ,13]短周期元素W、X、Y、Z的原子序数依次增加。m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,0.01mol·L-1r溶液的pH为2,s通常是难溶于水的混合物。上述物质的转化关系如图所示。推断元素:W____、X____、Y____、Z____。
6.[16 全国Ⅱ,9]a、b、c、d为短周期元素,a的原子中只有1个电子,b2-和C+离子的电子层结构相同,d与b同族。推断元素:a______、b______、c______、d______。
7.[15 全国Ⅰ,12]W、X、Y、Z均为短周期主族元素,原子序数依次增加,且原子核外L电子层的电子数分别为0、5、8、8,它们的最外层电子数之和为18。则元素W为____、X为____、Y为____、Z为____。(填元素符号)
8.[15 全国Ⅱ,9]原子序数依次增大的元素a、b、c、d,它们的最外层电子数分别为1、6、7、1。a-的电子层结构与氦相同,b和c的次外层有8个电子,c-和d+的电子层结构相同。推断元素:a_____、b_____、c_____、d_____。(填元素符号)
9.[14 全国Ⅰ,10]X、Y、Z均为短周期元素,X、Y处于同一周期,X、Z的最低价离子分别为X2-和Z-,Y+和Z-具有相同的电子层结构。则元素Y是____,Z是____,X是______。(填元素符号)
一、元素周期表
1.族数与纵行数的关系(填写空白内容)
2.★不同周期元素种类及稀有气体的原子序数
注意:由于第七周期元素已经填满,不再称为“不完全周期”。
二、化学键(必修)
1.化学键
化学键是离子或原子间的一种作用力。
(1)
(2)概念:
①离子键:带相反电荷的阴、阳离子之间强烈的相互作用。形成条件:通常是活泼金属元素与活泼非金属元素的原子相结合。如Na2S、CaCl2、NaCl等。
②共价键:原子间通过共用电子对形成的相互作用。如H2O、H2O2、HCl等。形成条件:通常是非金属元素的原子相结合;复杂离子内部存在共价键。
a.非极性键:共用电子对不发生偏移。键合原子:同种元素的原子。
b.极性键:共用电子对偏向吸引电子能力强的原子一方。键合原子:不同种元素的原子。
三、离子化合物和共价化合物
1.离子化合物
(1)概念:阴、阳离子通过离子键结合的化合物(一定含有离子键,可以含有共价键)。
(2)构成微粒:阴、阳离子(判断:一般为含有金属或铵根的化合物)。
2.共价化合物
(1)概念:只含有共价键的化合物(不能含有离子键,也不能是单质)。
(2)构成微粒:分子或原子(判断:一般由非金属元素组成的物质(铵根除外)。
3.物质的类别与键的极性
【考型1】原子序数与周期表中的位置
1-1.[15 安徽,25]Si位于元素周期表第__周期第___族。
1-2.判断下列正误:(https://www.xing528.com)
(1)[17 北京,8]2016年IUPAC命名117号元素为TS(中文名“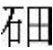 ”,tián),TS的原子核外最外层电子数是7,则TS是第七周期第ⅦA族元素( )
”,tián),TS的原子核外最外层电子数是7,则TS是第七周期第ⅦA族元素( )
(2)[17 天津,5]用中文“ ”(ào)命名的第118号元素在周期表中位于第七周期0族( )
”(ào)命名的第118号元素在周期表中位于第七周期0族( )
【考型2】元素推断
2-1.判断正误:[17 海南,19]某元素原子核外电子总数是最外层电子数的5倍,则其最高正价为+7( )
2-2.[16 全国Ⅲ,12]四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的,W与Y同族,Z与X形成的离子化合物的水溶液呈中性。推断元素:W_______、X_______、Y_______、Z_______(填元素符号)。
【考型3】共价键和离子化合物
3.[双选]下列判断正确的是( )
A.[天津高考]IA族与VIIA族元素间可形成共价化合物或离子化合物
B.[16 浙江,9]化合物Na2O和NaClO3都只存在离子键
C.[15 全国Ⅰ,12]N与P不能存在于同一离子化合物中
D.[17 江苏,1]H、N、O三种元素可以组成共价化合物和离子化合物
一、元素“构、位、性”的关系
1.元素在周期表中的位置,即确定周期数和族序数,周期数常用一、二、三表示,主族序数用ⅠA、ⅡA、ⅢA…表示,稀有气体用0表示;熟记前20号元素的原子序数的元素符号,几个关系式:
原子序数=原子的核电荷数=原子的核外电子数。
周期数=电子层数;主族元素的族序数=最外层电子数
2.最外层电子数=主族元素的最高正价(O与F除外)=8-|最低负价|(H除外)。
金属元素只有正化合价,非金属元素既有正化合价,也有负化合价(F无正价)。
3.最外层电子数>次外层的电子数,元素一般在第二周期;最外层电子数<次外层的电子数,元素一般在第三周期。注意核外电子数与最外层电子数的区别;最外层电子数为8电子的稳定结构与核外18电子的稳定结构的不同叙述。
4.★常考的同族元素:H与Na;N与P;O与S。
5.同周期主族元素的原子半径最大的是ⅠA元素的原子,短周期主族元素的原子半径最大的是Na,非金属性最强的元素是F,最高价含氧酸酸性最强的元素是Cl。
二、由元素的原子序数确定在周期表中的位置
先找到比所给元素原子序数小且相邻的稀有气体的原子序数,该元素的周期数就是稀有气体的周期数加1,再用“该元素的原子序数-上周期稀有气体的原子序数=余数”。
①★为短周期时,余数=该元素所在周期的主族序数
②为四,五周期时,余数=该元素所在周期的纵行数。例如:原子序数为51:51-36=15,(第五周期,第15纵行,VA)。
③*为六,七周期时,镧系和锕系的存在,情况复杂,余数≤2时,数主族序数;余数>18时,余数-14所得数即为该元素所在纵行数。例如:原子序数78:78-54=24>18,则24-14=10,第10纵行VⅢA)。
有趣的是第七周期的稀有气体元素为118号,恰好是18个纵行(原子序数的后2位数),0族,由此可推知,该周期的ⅢA~ⅦA主族元素,即与原子序数的个位数相同,如114号元素为第ⅣA族。
三、元素推断
1.元素范围界定
(1)短周期(主族)元素(前18号元素)或前20号元素(18号元素,再加上K、Ca元素);(2)是否是“原子序数依次增加”,否则,随机排布;原子序数依次增大的排布中,第一种元素可能为H;讨论元素的周期性,最好画简单周期表,并将元素放入表中讨论。
2.微粒结构与电子排布
(1)普通H原子核内只有1个质子,没有中子;H+没有电子,即为质子;H-与He的电子层结构相同。
(2)短周期中,简单离子都具有稳定的电子层结构。阴离子与其下一周期的阳离子都具有相同的电子层结构,即:10电子结构:N3-、O2-、F-、(Ne)、Na+、Mg2+、Al3+;18电子结构:S2-、Cl-、K+、Ca2+的电子层结构相同。
3.物质的性质
(1)化合物的类别分析。
①共价化合物常见类别为:非金属的氢化物,部分非金属的氧化物,含氧酸、大部分有机物等。②离子化合物常见类别为:强碱、大部分盐、活泼金属氧化物等,一般是含有金属元素或铵根离子的化合物。
(2)物理性质:黄绿色气体通常为Cl2;常温常压下为液态的氢化物为H2O、H2O2;从物质的存在状态比较沸点:固态>液态>气态。
4.元素的组成
(1)与氧元素形成多种化合物常考的元素有:H、S、N、C、Na等。
(2)以XnYZm为表现形式的化合物,元素Z最可能为O元素,化合物可能是酸或盐。由四种元素形成的化合物通常是含氧酸根的酸式盐、碱式盐和铵盐等。
(3)物质组成的特殊配比:能形成原子个数比为2:1或1:1的特殊化合物有:Na2O与Na2O2,Na2S与Na2S2,其中Na2O2与Na2S2是含有非极性共价键的离子化合物;H2O与H2O2,C2H4与C2H2、C6H6是含有非极性共价键的共价化合物分子。
(4)注意必修有机物的引入:如Cl2与CH4在光照条件下得到一系列难溶于水的混合物(CH3C1、CH2C12、CHCl3、CCl4)。
(5)特殊的转化关系
则Y为H2,X、Z为Cl2、N2。
(6)给出一定c(浓度)下的pH值,常用于定性判断物质的性质:强酸与弱酸,强碱与弱碱,水解的盐(强弱盐),如:0.01mol·L-1R溶液:①pH=2时R为一元强酸;②pH>2时R可能为弱酸,或强酸弱碱盐。③pH=7,盐可能是NaCl等中性溶液。
(7)推断元素时,可将结论带入验证其合理性。
四、化学键和化合物
1.共价键和共价化合物:共价键主要是非金属原子之间通过共用电子对形成,复杂离子内部(如NH4+、OH-、SO24-等),在部分非金属原子和金属原子之间也可能形成共价键,如AlCl3、BeCl2等。一般在非金属单质(稀有气体除外)、非金属氧化物、气态氢化物、酸、大多数有机物等主要属于共价化合物;共价化合物中只能含有共价键,不能含有离子键;完全由非金属元素也能形成离子化合物,这主要是指含由铵根(NH+4)离子形成盐。
2.离子键与离子化合物:活泼金属氧化物、强碱、大部分盐、金属氢化物等属于离子化合物;离子化合物中一定含有离子键可能含有共价键;复杂离子内部以共价键相结合。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




