【高考化学·考试大纲】(1)了解元素、核素和同位素的含义。(2)了解原子的构成。了解原子序数、核电荷数、质子数、中子数、核外电子数以及它们之间的相互关系。(3)掌握原子结构示意图、电子式、分子式、结构式和结构简式等表示方法。(4)了解原子核外电子排布规律。
【课程标准·学业要求】能画出1~20号元素的原子结构示意图。
1.[18 全国Ⅲ,8]下列叙述正确的是( )
A.24g镁与27g铝中,含有相同的质子数
B.同等质量的氧气和臭氧中,电子数相同
C.1mol重水与1mol水中,中子数比为2∶1
D.1mol乙烷和1mol乙烯中,化学键数相同
2.[17 全国Ⅲ,28]砷(As)是第四周期ⅤA族元素,画出砷的原子结构示意图____________。
3.[16 全国Ⅱ,26]联氨(N2H4)分子的电子式为_________。
4.[15 全国Ⅰ,27]硼氢化钠(NaBH4)的电子式为。
一、构成原子的粒子
二、原子构成的表示
三、各量之间的关系
质量数(A)=_____数(Z)+_____数(N)≈原子的相对原子质量;质子数=______数=______数=_________数。
离子电荷数(包括符号)=质子数-核外电子数
四、元素、核素、同位素(三素)的概念
1.原子:____________中的最小微粒。
2.元素:具有相同质子数的同一类原子的总称。
3.核素:具有一定数目的_____和一定数目的______的一种原子。AZX即为核素符号。
4.同位素:具有相同_____数和不同_____数的同一______的原子的互称。
同位素原子间为不同的核素;微粒的电子数和质子数相同,而中子数、原子的相对原子质量不同。不同元素的原子之间,电子数和质子数不同,而中子数和质量数可能相同,原子的相对原子质量可能相同。
五、两种相对原子质量
1.原子的相对原子质量(也即同位素原子或核素相对原子质量):以一个12C原子质量的1/12作为标准,其他原子的质量跟它相比较所得的数值。同位素原子的近似相对原子质量=同位素原子的质量数(考试中通常在给出的近似同位素原子中使用)。
2.元素的相对原子质量:是按该元素的各种同位素的原子百分比与其相对原子质量的乘积相加所得。元素周期表中的相对原子质量就是指元素的相对原子质量。
计算公式为:元素的相对原子质量=M1×a%+M2×b%+…
其中M为同位素原子的相对原子质量,a%、b%为各同位素的原子个数百分比。
*例如:氯元素在自然界有35Cl和37Cl两种同位素,有关量如下表:
在元素周期表中,每一个位置表示的是元素而不是原子,同种元素的不同核素都放在同一个位置,所以,只能标明元素符号和名称,原子序数和核外电子排布,元素的相对原子质量;不能标明中子数、质量数和原子的相对原子质量。计算相对平均分子质量时,用类似的方法。
六、电子式
1.概念:在元素符号周围用小黑点(或×)来表示原子的最外层电子的式子。
2.离子化合物的电子式:在离子化合物的电子式中,简单的阳离子一般用_____符号表示。阴离子或铵根等复杂离子的电子式书写时,要注意三点:即(1)电子数(一般最外层是2或8电子的稳定结构);(2)加中括号;(3)标明离子所带的电荷数,并注意排列顺序要阴、阳离子相间。
如(小黑点与小叉在考试中不作区分):
Na2S:_____________、MgBr2:___________、
Na2O2:____________、NH4Cl:___________。
3.共价化合物的电子式:这类共价化合物或共价单质属于分子型物质,由于原子之间是通过共用电子对结合而成的,没有阴阳离子,因此不出现阴阳离子的电荷和中括号的写法。
如:HCl:_____、H2O:________、NH3:_______。
【考型1】原子核及其微粒数之间的关系
1-1.[海南高考]重水(D2O)是重要的核工业原料,下列说法错误的是( )
A.氘(D)原子核外有1个电子
B.1H与D互称同位素
C.H2O与D2O互称同素异形体
D.1H218O与D216O的相对分子质量相同
1-2.[17 海南,3]下列分子其中子总数为24的是( )
A.18O3 B.2H217O2 C.14N16O2 D.14C16O2
【考型2】同位素示踪法
2.[15 北京,27]同位素示踪法证实光合作用释放出的O2只来自于H2O,用18O标记物质的光合作用的化学方程式如下,将其补充完整:
【考型3】电子式与原子结构示意图的书写
3-1.[15 天津,7]从氢、碳、氮、氧、钠、铝、硫、氯元素组成一种四原子共价化合物,写出其电子式:____________________________________________。
3-2.[14 重庆,8]Na原子结构示意图为_______________,Na在氧气中完全燃烧所得产物的电子式为_______。(https://www.xing528.com)
【考型4】结构用语的综合判断
4-1.[16 江苏,2]下列有关化学用语表示正确的是( )
A.中子数为10的氧原子:108O
B.Mg2+的结构示意图: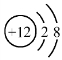
C.硫化钠的电子式:![]()
D.甲酸甲酯的结构简式:C2H4O2
4-2.[18 江苏,2]用化学用语表示NH3+HCl==NH4Cl中
的相关微粒,其中正确的是( )
A.中子数为8的氮原子:78N
B.HCl的电子式:![]()
C.NH3的结构式:![]()
D.Cl-的结构示意图:![]()
一、基本概念
1.同位素、同素异形体的概念比较
解题时,首先思考概念“研究的微粒对象或前提”是否正确,再分析“表示形式”和结论。
同素异形体之间的转变属于化学变化,属于非氧化还原反应。碳能形成多种同素异形体,如金刚石、石墨、石墨烯、富勒烯(C60)或碳纳米管等。
同位素反映的是同种元素的不同原子间的关系。如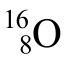 和188O是同位素,而146C和174N不是同位素。单质、化合物间不存在同位素的关系。如H2和D2既不是同位素,也不是同素异形体,化学性质相似。
和188O是同位素,而146C和174N不是同位素。单质、化合物间不存在同位素的关系。如H2和D2既不是同位素,也不是同素异形体,化学性质相似。
核素之间的转变,或同位素之间的转变,原子核发生了变化属于物理变化(物理中的核反应),不属于化学变化。
★特点:(1)同位素原子之间具有相同的电子数和相同的核外电子排布,所以化学性质几乎完全相同。(2)自然界中稳定同位素的原子个数百分数不变。
2.元素、核素、同位素之间的关系
元素只有确定的质子数,无确定的中子数或质量数。
二、*同位素的应用
1.常见的重要核素及其应用
 (核燃料)、
(核燃料)、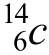 (考古断代)、
(考古断代)、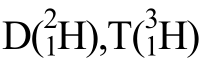 (制氢弹)。
(制氢弹)。
2.同位素示踪法研究反应历程
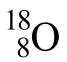 示踪原子法,将研究对象中的氧原子进行标记,研究反应过程中原子的转移情况。如研究酯的水解:
示踪原子法,将研究对象中的氧原子进行标记,研究反应过程中原子的转移情况。如研究酯的水解:
从而明确历程中的“酸脱羟基醇脱氢”。
三、结构用语
1.原子结构示意图
必修内容主要限定在前20号元素的原子结构示意图:
前20号元素的核外电子主要以“2(K层)→8(L层)→8(M层)→2(N层)”顺序,由内层依次向外层排布电子。原子结构示意图分为原子结构示意图(核电荷数=核外电子数),和离子结构示意图(核电荷数≠核外电子数),离子结构示意图的外层电子通常是稳定结构。如:Mg2+离子结构示意图为![]() ;Cl-离子结构示意图为
;Cl-离子结构示意图为![]() 。
。
2.电子式的书写
(1)电子式书写四注意:
一注意物质类型:分清离子化合物与共价化合物的类型,这决定了两种不同的写法。
二注意价性和价数:在写电子式时要按正负化合价(或阴阳离子)相间的原子排列方式,构成中的多个微粒不能合并书写,化合价的“价数”在离子化合物中等于离子所带电荷数,在分子中一般等于原子的共用电子对的数目(H一价、C四价、O二价、N三价、S二价、卤素原子X一价)。
三注意稳定结构:现在高考中所写物质的电子式,一般都为稳定结构(有机物中的“基”除外),即成键后价层电子数为8或2。
四注意电子数守恒:即各原子的最外层电子数之和等于电子式中的电子总数。
书写电子式的物质主要是小分子和离子化合物,原子晶体不要求写电子式,这点可用于检证推断的物质。
(2)对应上面4点,杜绝电子式书写的典型错误:
3.几种结构用语的区别与联系
结构用语主要有:化学式、分子式、电子式、结构式、结构简式、原子(离子)结构示意图等。答题时首先必须细审题,弄清分析的对象。
只有表示分子型物质组成的式子才是真实意义上的“分子式”。表示离子化合物、原子晶体、金属单质组成的式子通称为“化学式”,在概念判断中不能叫做分子式。
电子式与结构式可以相互转变,对于一些新分子可先写出结构式,然后再改写成电子式。
例如:
四、*寻找10电子微粒和18电子微粒的思维方法
(1)10电子微粒
(2)18电子微粒
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




