【高考化学·考试大纲】了解常见金属的活动顺序。了解合金的概念及其重要应用。
【课程标准·学业要求】能说明常见元素及其化合物的应用(如金属冶炼、合成氨等)对社会发展的价值、对环境的影响。
1.[18 全国I,7]磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。采用湿法冶金工艺回收废旧磷酸亚铁锂电池正极片中的金属,其流程如下:
下列叙述错误的是( )
A.合理处理废旧电池有利于保护环境和资源再利用
B.从“正极片”中可回收的金属元素有Al、Fe、Li
C.“沉淀”反应的金属离子为Fe3+
D.上述流程中可用硫酸钠代替碳酸钠
2.[15 全国Ⅱ,12]海水开发利用的部分过程如下图所示。
下列说法错误的是( )
A.向苦卤中通入Cl2是为了提取溴
B.粗盐可采用除杂和重结晶等过程提纯
C.工业生产中常选用NaOH作为沉淀剂
D.富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收
3.[15 全国Ⅰ,28]大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加MnO2和H2SO4,即可得到I2,该反应的还原产物为____________。
4.[14 全国Ⅱ,36]海水提镁的一段工艺流程如下图:
浓海水的主要成分如下:
该工艺过程中,脱硫阶段主要反应的离子方程式为__________________________,产品2的化学式为_____________,1L 浓海水最多可得到产品2的质量为________g。
一、海水资源的综合利用
1.海水淡化的方法:蒸馏法、电渗透法、离子交换膜法。
2.实验室海水提碘:![]()
![]()
二.金属的冶炼
金属冶炼的方法与金属活泼性顺序有关:
(1)电解法(Al以前的活泼金属)
熔融电解:Al2O3→Al;MgCl2→Mg
(2)热还原法(适用于Zn—Cu等中等活泼金属)
①焦炭还原法:
②一氧化碳还原法:
③氢气还原法:
④活泼金属还原法,如铝热反应:
(3)热分解法(适用于Hg、Ag等不活泼金属)
重要化工生产的基本反应(见附录)
【考型1】海水资源的综合利用(https://www.xing528.com)
1.[海南高考]溴及其化合物广泛应用于医药、农药、纤维、塑料阻燃剂等,回答下列问题:
(1)海水提溴过程中,向浓缩的海水中通入______,将其中的Br-氧化,再用空气吹出溴;然后用碳酸钠溶液吸收溴,溴歧化为Br-和BrO-3,其离子方程式为______________________________。
(2)溴与氯能以共价键结合形成BrCl。BrCl分子中,________显正电性。BrCl与水发生反应的化学方程式为________________。
【考型2】铝土矿中提炼Al2O3
2.[全国高考]铝土矿的主要成分是Al2O3和SiO2等。从铝土矿中提炼Al2O3的流程如下:
(1)写出反应1的化学方程式_________________________________________________;
(2)滤液Ⅰ中加入CaO生成的沉淀是__________,反应2的离子方程式为__________________;
(3)电解制铝的化学方程式是_________________,以石墨为电极,阳极产生的混合气体的成分是___________。
一、海水资源的综合利用——溴的制取
工艺流程:![]()
![]()
![]()
主要反应:①Cl2+2NaBr==2NaCl+Br2
②3Br2+3Na2CO3==5NaBr+NaBrO3+3CO2
③5NaBr+NaBrO3+3H2SO4==3NaSO4+3Br2+3H2O
②③过程称为“溴的富集”。
二、从铝土矿中制铝
铝土矿(主要成分:Al2O3、SiO2、Fe2O3),制铝的主要工艺流程:
1.铝土矿![]()
主要反应:
①Al2O3(铝土矿)+2NaOH==2NaAlO2+H2O
②NaAlO2+CO2+2H2O==NaHCO3+Al(OH)3↓
③2Al(OH)3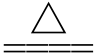 Al2O3+3H2O
Al2O3+3H2O
④![]() (冰晶石作助熔剂,降低Al2O3熔点)
(冰晶石作助熔剂,降低Al2O3熔点)
不能用电解AlCl3的方法制取Al,因为AlCl3是由分子构成的共价化合物,加热易升华,且不导电。
三、化工生产适宜条件的选择
选择适宜条件的目的:加快反应速率,提高反应物的转化率,根据外界条件对化学反应速率和化学平衡影响的规律,确定其原则:
1.对任一可逆反应,增大反应物浓度,能提高反应速率和另一种原料的转化率。故生产中常使廉价易得的原料适当过量,以提高另一原料的利用率,如氮气与氢气的配比为1.07:3。
2.对气体分子数减少的反应,增大总压使平衡向增大生成物的的方向移动。
3.对放热反应,升温,提高反应速率,但平衡转化率降低,若温度太低,反应速率又会减慢,故需使用适当的催化剂,选择使催化剂活性最高的反应。
对吸热反应,升温,既能加快反应速率,又能提高转化率,但要避免反应物或生成物的过热分解。
4.使用催化剂(工业上又称为触媒)能大大提高反应速率且不影响化学平衡,但使用时必须注意其活性温度范围,在该温度范围内催化剂的活性最高,还需防止催化剂“中毒”,延长使用寿命。
5.★效益原则:加压有利于氨的合成,但压强太大,动力消耗大,设备要求高、成本增大,故必须综合考虑。同理,在硫酸工业催化氧化中由于通入空气和在常压下反应时,SO2的转化率已经高达98%,所以,不需采用通入氧气和加压的方法来提高转化率。
6.循环操作,节省资源,提高原料转化率和利用率。例如合成氨工业、硝酸工业、接触法制硫酸、联合制碱法等工艺流程中采取了体现“绿色化学”中节省能源的基本原则。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




