【高考化学·考试大纲】了解常见非金属元素N的单质及其重要化合物的制备方法,掌握其主要性质及其应用。
【课程标准·学业要求】(1)能列举、描述、辨识典型物质重要的物理和化学性质及实验现象。(2)能用化学方程式、离子方程式正确表示典型物质的主要化学性质。
1.[双选]下列判断正确的是( )
A.[全国高考Ⅰ]可用蘸浓盐酸的棉棒检验输送氨气的管道是否漏气
B.[15 全国Ⅱ,13]将浓硝酸滴加到用砂纸打磨过的铝条上,产生红棕色气体
C.[17 全国Ⅱ,13]加热盛有少量NH4HCO3固体的试管,并在试管口放置湿润的红色石蕊试纸,石蕊试纸变蓝,说明NH4HCO3显碱性
D.[17 全国Ⅰ,12]氧的简单氢化物的热稳定性比氮的强
E.[17 全国Ⅲ,12]氧化物对应水化物的酸性:Al>N
2.[16 全国Ⅱ,26]联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料。
(1)联氨分子的电子式为_________,其中氮的化合价为______。
(2)实验室可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式为___________________。
(3)已知:2N2H4(l)+N2O4(l)==3N2(g)+4H2O(g) ΔH=-1048.9kJ/mol;联氨和N2O4可作为火箭推进剂的主要原因为____________________。
一、氮气
1.氮气结构
电子式为__________,结构式为_______________。
2.氮气的化学性质
由于N2分子中2个N原子形成三个共价键,键能大,N2是N元素最稳定的存在形式。主要反应如下:
(1)合成氨反应:N2+3H2![]() _______
_______
(2)与氧化反应:![]() _______
_______
(3)与Mg反应:![]() _______
_______
3.氮的固定
将游离态氮转变为化合态氮的方法叫做氮的固定。如工业合成氨为人工固氮;雷雨天产生NO气体就属于自然固氮。
二、氮的氧化物
1.氮元素的化合物
氮元素有+1、+2、+3、+4、+5等五种正价态,在氧化物中_______和_______是酸性氧化物,分别是HNO2和HNO3的酸酐。NOx都是________污染物,空气中的NO2是造成光化学污染的主要因素。
2.NOx的性质
(1)NO是____色、难溶于水的气体,易被O2氧化为NO2,化学方程式为:2NO+O2==__________
(2)NO2是_____色、易溶于水、并且易与水反应的气体:3NO2+H2O==________________
+4价的N有两种气态氧化物,常温下相互转化而共存:2NO2(红棕色) N2O4(无色)
N2O4(无色)
(3)NO2氧化性强(近似看成稀硝酸的氧化性),溶液中能氧化SO2,能使湿润的KI淀粉试纸变蓝。
三、氨气
1.氨的结构
电子式_______,结构式________,氨是极性分子。
2.物理性质
氨是无色、有刺激性气味,比空气轻的气体,______液化;液氨汽化时要吸收大量的热,因此作制冷剂;氨______溶于水,其水溶液叫氨水。
3.碱性气体
(1)与水的反应:
氨气是中学化学中唯一能使湿润的______石蕊试纸变蓝的碱性气体,加热氨水,平衡左移,碱性减弱,生成氨气。
NH3·H2O不稳定,受热时易分解:NH3·H2O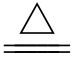 _________
_________
(2)与HCl反应:NH3(g)+HCl(g)===__________
NH3(g)与盐酸挥发的HCl气体在空气中相遇产生白烟,原因是二者反应生成NH4Cl固体小颗粒(遇到不挥发性酸如H2SO4等不产生白烟)。
(3)向AlCl3溶液中加入过量的氨水,离子方程式为:Al3++3NH3·H2O==_______________。
4.还原性
氨的催化氧化:![]() ____________
____________
四、铵盐
1.结构
NH+4的电子式 铵盐中存在的化学键类型有________________。
铵盐中存在的化学键类型有________________。
2.物理性质
都是易溶于水的晶体。
3.化学性质
(1)铵盐受热都容易分解
NH4Cl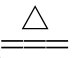 ____________________
____________________
NH4HCO3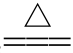 ___________________
___________________
注意:分解后的气体遇冷又生成盐,所以,不能用加热铵盐分解的方式制取氨气。
(2)铵盐与NaOH溶液加热的离子方程式为:
NH+4+OH-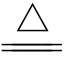 _____________
_____________
注意:一般加热才生成氨气。
(3)铵盐的水解:![]()
4.NH+4的检验
操作与现象:取少许样品与浓NaOH溶液混合于试管中并加热,将湿润红色石蕊试纸靠近瓶口,若试纸变蓝,证明样品中含有NH+4;反之则没有NH+4。
5.铵态氮肥
主要是指氨水及铵盐,如(NH4)2SO4、NH4Cl、NH4HCO3等。
五、硝酸
硝酸除了具有酸的通性外,还具有特殊性质
1.不稳定性
4HNO3(浓)![]() _____________________。
_____________________。
硝酸越浓越易分解,所以浓硝酸常呈棕色(溶有NO2);故浓硝酸存放在_______试剂瓶,并置于____处。
2.硝酸的强氧化性
金属与硝酸反应都不能生成H2,默认浓HNO3还原产物为______,稀HNO3还原产物为_____,不指明浓度时,常按稀硝酸处理。
(1)浓、稀硝酸与Cu反应的方程式分别为:
Cu+4HNO3(浓)==______________________
3Cu+8HNO3(稀)==____________________
现象:铜片溶解,溶液变成______色,有无色气泡产生,液面上方变为_______色。
以上反应中,硝酸表现:_________性和_____性。
(2)硝酸与非金属反应,在加热条件下,非金属被氧化成最高价氧化物或含氧酸。如碳与浓硝酸反应的方程式为:
C+4HNO3(浓) _____________________
_____________________
以上反应中,硝酸表现:___________。
(3)铝、铁遇冷的浓HNO3产生________现象,表现了浓硝酸______性。但在加热条件下铝、铁能被浓硝酸氧化而溶解。
六、*磷及其化合物
1.单质磷
常见的同素异形体有两种:白磷(分子晶体,分子式为P4),在空气中容易自燃,能溶于CS2;另一种是红磷。
2.化学性质(1)在空气中燃烧:![]() (产生大量白烟)(https://www.xing528.com)
(产生大量白烟)(https://www.xing528.com)
(2)P2O5是酸性氧化物,P2O5+![]()
P2O5常用作干燥剂,H3PO4是一种非氧化性的中等强度的三元酸,具有酸的通性。
(3)在氯气中燃烧
现象:产生大量的白色烟雾。
七、氮元素的价类二维转化关系
【考型1】硝酸的氧化性
1.[15 北京,12]在通风橱中进行下列实验:
下列说法不正确的是( )
A.Ⅰ中气体由无色变红棕色的化学方程式:2NO+O2==2NO2
B.Ⅱ中的现象说明Fe表面形成致密的氧化膜,阻止Fe进一步反应
C.对比Ⅰ、Ⅱ中现象,说明稀硝酸的氧化性强于浓硝酸
D.针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否被氧化
【考型2】氨和铵盐
2.[福建高考]下列物质与水作用形成的溶液能与NH4Cl反应生成NH3的是( )
A.二氧化氮 B.钠 C.硫酸镁 D.二氧化硅
【考型3】氨气的实验室制法
3.[15 广东,33](1)用NH4Cl和Ca(OH)2制备NH3,反应发生、气体收集和尾气处理装置依次为。
(2)按如图装置进行NH3性质实验。
①先打开旋塞1,B瓶中的现象是,原因是,稳定后,关闭旋塞1。
②再打开旋塞2,B瓶中的现象是____________________________________。
【考型4】氮氧化物与亚硝酸盐
4.下列说法错误的是( )
A.[天津高考]NO2溶于水时发生氧化还原反应
B.[14 天津,2]制二氧化氮时,用水或NaOH溶液吸收尾气
C.[17 海南,6]用氢氧化钠溶液吸收工业废气中的NO2:2NO2+2OH-==NO-3+NO-2+H2O
【考型5】喷泉实验
5.判断下列正误:
(1)[14 广东,9]NH3能使酚酞溶液变红,所以可用于设计喷泉实验( )
(2)[山东高考]分别充满HCl、NH3的烧瓶倒置于水中后液面均迅速上升,说明二者均易溶于水( )
一、硝酸氧化性及其隐形条件
1.硝酸根的氧化性
在中性或碱性条件下,NO3-不
与其他离子发生氧化还原反应,但如果引入酸性条件,则NO-3具有强氧化性,能氧化Fe2+、I-、Br-、SO2-3、S2-、HS-等离子,考试中要特别注意操作中隐藏着的“酸性条件”的改变。
以硝酸作氧化剂时,常释放出氮氧化物气体(如NO、NO2等),会造成环境污染。此点在实验题、化工流程题中常涉及到。
2.硝酸与铁反应
(1)常温下,浓硝酸使铁、铝发生钝化,近年来认为,钝化时先观察到有少量红棕色气体出现,随即停止。
(2)稀硝酸能将Fe氧化成Fe(NO3)3,稀硝酸默认还原成NO,事实上金属与硝酸的反应,硝酸的浓度越低,金属越活泼,氮元素被还原的价态就越低,如还原成N2O、NH4NO3等,试题会以信息或探究性的方式处理这种情况。
(3)反应中,当Fe过量时,Fe+2Fe(NO3)3 3Fe(NO3)2,最终得到的是Fe(NO3)2。
3Fe(NO3)2,最终得到的是Fe(NO3)2。
二、氨与铵盐
1.氨有较强的还原性,常以拓展的形式进行考查:
(1)与氧化铜反应:![]()
(2)与氮氧化物反应:![]()
(3)与氯气反应:8NH3+3Cl2==4N2+6NH4Cl
现象:产生白烟。可用蘸浓氨水的棉棒检验输送氯气的管道是否漏气。
2.生产上,氨常作为碱性物质与酸反应,调节溶液的pH值,使反应发生。如:侯氏制碱法中将CO2通入NaCl溶液中不反应,常先通入NH3使溶液呈碱性,再通入CO2使反应进行。在氨参与的反应溶液中,温度过高可能导致氨气的挥发而影响反应的进行。
(1)NH3+H2O+CO2==NH4HCO3(首先通入氨气,然后再通入二氧化碳)。
(2)NH4HCO3+NaCl==NH4Cl+NaHCO3↓(NaHCO3溶解度最小,所以析出)。
3.氮的其他氢化物:氮的氢化物在结构上与氧的氢化物相似,在考试中,常通过类比的方法进行考查,两者比较如下:H2O与NH3、H3O+与NH+4、OH-与NH-2(均为10电子);H2O2与N2H4、-OH与-NH2。
三、★氨气的实验室制法
1.原理:用铵盐(NH4Cl)与消石灰混合加热制备NH3,化学方程式为:
注意:不能用NH4Cl、NH4HCO3直接加热分解的方法制取NH3,因为分解产物遇冷,又生成铵盐。
2.装置:“固+固 气”装置。
气”装置。
3.收集:只能用向下排空气法收集。
4.干燥:选用盛CaO,或碱石灰的干燥管干燥。
5.检验:★用润湿的红色石蕊试纸检验(变蓝)。
6.吸收:要用防倒吸装置(如上右图)。原理:氨气极易溶于水,容易发生倒吸。
7.★其他制法
(1)浓氨水受热分解。原理:减少水的用量,强碱性溶液加热,都有利于氨气的逸出。
(2)将浓氨水滴入到氧化钙或氢氧化钠固体中。原因:反应消耗水、反应放热。
NH3+H2O NH3·H2O
NH3·H2O NH4++OH-,平稳向左移动
NH4++OH-,平稳向左移动
四、氮氧化物与硝酸盐
1.“2NO2 N2O4”反应涉及的知识
N2O4”反应涉及的知识
必须思考的转化关系:
*以此为据,在考试中可能的几个讨论:
①lmolNO2的体积应小于22.4L(折算成标准状况)
②22.4L(折成标准状况)NO2的质量大于46g。
③在标准状况下,NO2是液态,可用冰水冷却的方式分离NO、NO2。
④NO与O2混合后,相对分子质量应大于按体积比求得的数值。
2.亚硝酸及亚硝酸盐
NaNO2有食盐的咸味和外观,误食用后会使人中毒。
HNO2是不稳定的一元弱酸,既有氧化性又有还原性。
亚硝酸及亚硝酸盐的生成分析:NO2+NO→![]()
*以此推导出:
(1)NO2+NO+2NaOH==2NaNO2+H2O(氮元素的归中反应)
(2)2NO2+2NaOH==NaNO3+NaNO2+H2O(氮元素的歧化反应)
NO2可用NaOH溶液进行尾气完全吸收(不是生成NO)。所以,常用NaOH溶液作为NOx的吸收剂。
五、喷泉实验
原理:使烧瓶内在短时间内产生较大的负压,利用大气压将液体压入烧瓶内形成喷泉。
形成条件:(1)气体能大量溶于所用液体或气体快速与液体反应。(2)装置气密性好。
常见题型:分析能否形成喷泉;喷泉实验后溶液浓度的计算。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




