【高考化学·考试大纲】了解常见非金属元素H、O、S的单质及其重要化合物的制备方法,掌握其主要性质及其应用。
【课程标准·学业要求】(1)能列举、描述、辨识典型物质重要的物理和化学性质及实验现象。(2)能用化学方程式、离子方程式正确表示典型物质的主要化学性质。
1.[16 全国Ⅲ,36]在生产中某步加入氧化剂使Fe2+转变成Fe3+,下列氧化剂中最合适的是( )
A.KMnO4 B.Cl2 C.H2O2 D.HNO3
2.[双选]下列判断正确的是( )
A.[14 全国Ⅰ,13]将浓硫酸滴入到蔗糖的试管中,再将生成的气体导入溴水,可得出结论:浓硫酸具有脱水性、氧化性
B.[14 全国Ⅰ,13]稀盐酸滴入到Na2SO3的试管中,再将产生的气体导入Ba(NO3)2溶液,以证明SO2与可溶性钡盐均可生成白色沉淀
C.[14 全国,6]室温下,不能将浓硫酸盛放在铁桶中
D.[14 全国,8]SO2使溴水褪色与乙烯使KMnO4溶液褪色的原理相同
E.[18 全国Ⅱ,13]探究浓度对反应速率的影响:可通过向2支盛有5mL不同浓度NaHSO3溶液的试管中同时加入2mL5%H2O2溶液,观察实验现象,达到实验目的
3.[16 全国Ⅱ,36]双氧水的浓度可在酸性条件下用KMnO4溶液测定,该反应的离子方程式为__________________________________________________。
4.[17 全国Ⅰ,27]Li2Ti5O15中Ti的化合价为+4,其中过氧键的数目为_______。
5.[16 全国Ⅲ,26]向CaCl2溶液中加放氨水和双氧水以制备过氧化钙,化学方程式为______________________________________,该反应需要在冰浴下进行,原因是_____________________。
一、硫及其化合物
1.硫单质
(1)物理性质:_____色晶体,属于分子晶体(分子式S(2~8)),易溶于CS2,微溶于酒精。游离态存在于火山口附近,在煤、石油和蛋白质里都含有一定量的化合态的硫。
(2)还原性:
氧气反应:S+O2 ____(★不生成_____)
____(★不生成_____)
(3)氧化性:
①与氢气反应生成![]()
②与铜和铁反应,生成低价金属的硫化物:
2Cu+S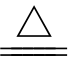 _____Fe+S
_____Fe+S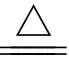 _____
_____
(4)与强碱溶液发生歧化反应:
6NaOH+3S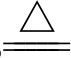 _______________
_______________
(用于洗涤附着硫的试管)
2.浓硫酸
(1)浓硫酸的吸水性(作气体干燥剂,除去湿存水或结晶水合物中结晶水)。
(2)浓硫酸的脱水性(使木条、纸张、蔗糖等炭化)。
(3)浓硫酸的强氧化性;
①常温使铁、铝等金属常温下钝化(常温下可以用铁桶盛放浓硫酸);加热条件下继续反应。
②与不活泼金属铜的反应:
Cu+2H2SO4(浓)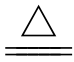 __________________
__________________
浓硫酸表现为:_________和_________
③与木炭反应(加热):
C+2H2SO4(浓) ____________________
____________________
浓硫酸表现为:____________性。
【黑面包实验】在烧杯中加入一定量蔗糖,滴加少量的蒸馏水(有利于浓硫酸吸水时放热),并搅拌均匀,将一定量的浓硫酸倒入烧杯里,并用玻璃棒不断搅拌。观察到:蔗糖变成黑色(浓H2SO4使有机物脱水、炭化),然后膨胀变大成“黑面包”,将气体通入溴水中溴水褪色,通入品红溶液褪色(生成SO2,浓硫酸氧化碳所至)。
④实验室不宜用浓硫酸制取和干燥物质,如:氨气(碱性);碘化氢、溴化氢、硫化氢等(还原性)。
(4)两种酸式盐:NaHSO4、NaHSO3NaHSO4===Na++H++SO2-4,相当于一元强酸。NaHSO3===Na++HSO-3 HSO-3
HSO-3 SO23-+H+(电离为主)HSO-3+H2O
SO23-+H+(电离为主)HSO-3+H2O H2SO3+OH-(水解为辅),溶液呈酸性。NaHSO4与NaHSO3反应的离子方程式为:
H2SO3+OH-(水解为辅),溶液呈酸性。NaHSO4与NaHSO3反应的离子方程式为:
H++HSO-3==H2O+SO2↑
(5)硫酸根离子的检验:先加过量稀盐酸,无明显现象,后加氯化钡溶液,有白色沉淀生成。加入稀盐酸是为了排除CO32-、SO32-、Ag+的干扰。
3.二氧化硫、亚硫酸或亚硫酸钠S(+4)的性质
(1)非氧化还原反应(酸性氧化物性质)
①与水反应:SO2+H2O _________
_________
(与碳酸性质相似易分解,但H2SO3酸性强于碳酸)
②具有酸性氧化物的通性,如与碱反应:
SO2+Ca(OH)2==________________
(2)弱氧化性表现在与硫化氢反应:2H2S+SO2==__________
(3)强还原性:被氧气、卤素、硝酸等氧化成SO42-
①被氧气氧化:2![]() ____________
____________
工业制硫酸。在空气中某些悬浮尘埃和阳光作用下被氧化成三氧化硫,溶于水成为酸雨。
②被卤素氧化:SO2+Cl2+2H2O==_____________
使氯水或溴水褪色,二者混合漂白能力减弱或消失。
③被硝酸氧化:
3SO2+2HNO3(稀)+2H2O===3H2SO4+2NO
④Na2SO3在空气中变质:2Na2SO3+O2==2Na2SO4
(4)检验:SO2使品红溶液褪色,加热后溶液颜色复原。(用于区分SO2和CO2;但SO2不能漂白指示剂,如SO2通入紫色石蕊试液只变红而不褪色)。
4.硫化氢的性质
(1)物理性质:__________气味,能溶于水。
(2)强还原性,能被常见的氧化剂氧化,如O2、Cl2、Br2、I2、Fe3+、SO2、浓硫酸、硝酸等。
①被空气氧化而变浑浊:2H2S+O2==________
(不完全燃烧或在溶液中的反应)
②与卤素单质如Cl2、Br2、I2反应:
Cl2+H2S==2HCl+S↓
(3)非氧化还原反应(酸性)
与CuSO4溶液反应生成黑色CuS:
CuSO4+H2S==_______________
①CuS不溶于酸。②该反应用于检验H2S或除去H2S气体。③多数金属的硫化物难溶于水:如PdS、HgS、ZnS。
5.硫代硫酸钠(Na2S2O3)的性质
Na2S2O3中S的化合价简单认为平均显+2价(也有人认为呈+4,-2价),可被较强的氧化剂(Cl2、Br2)氧化成硫酸根。
Na2S2O3+2HCl==__________________
(实验中测定温度,浓度对反应速率的影响)
6.硫元素的价类二维转化关系
二、臭氧(O3)
(1)物理性质:有特殊臭味的淡蓝色气体,与氧气互为同素异形体。
(2)化学性质
①不稳定性:2O3==3O2(升温分解速率加快)(https://www.xing528.com)
②强氧化性:O3+2KI+H2O==2KOH+I2+O2(湿润的淀粉-KI试纸变蓝)
③漂白和消毒:臭氧是一种很好的脱色剂和消毒剂。但空气中臭氧的含量超过10-5%时,会对人、动植物等造成危害。
(3)产生方式:![]()
臭氧层:能吸收来自太阳的紫外线辐射,是人类和生物的保护伞。氟氯烃及NO是破坏臭氧层的“元凶”。
【考型1】硫及其化合物的性质
1.[双选]下列判断正确的是( )
A.[15 天津,1]点燃爆竹后,硫燃烧生成SO3
B.[14 天津,2]增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率
C.[14 广东,9]BaSO4难溶于酸,所以可用盐酸和BaCl2溶液检验SO42-
D.[17 江苏,13]向久置的Na2SO3溶液中加入足量BaCl2溶液,出现白色沉淀;再加入足量稀盐酸,部分沉淀溶解;说明部分Na2SO3被氧化
E.[16 江苏,9]![]()
【考型2】酸性气体与盐溶液反应能否生成沉淀的讨论
2-1.判断正误:[15 重庆,2]SO2和SO3混合气体通入Ba(NO3)2溶液可得到BaSO3和BaSO4。( )
2-2.[15上海,12]与氢硫酸反应有沉淀生成的电解质是( )
A.硫酸铜 B.氢氧化钠 C.硫酸亚铁 D.二氧化硫
【考型3】钙基脱硫
3.[18 江苏,16]FeS2和金属硫酸盐的混合物,与添加1%CaO和不添加CaO的矿粉焙烧,其硫去除率随温度变化曲线下图所示。已知:多数金属硫酸盐的分解温度都高于600℃
(1)不添加CaO的矿粉在低于500℃焙烧时,去除的硫元素主要来源于______________。
(2)700℃焙烧时,添加1%CaO的矿粉硫去除率比不添加CaO的矿粉硫去除率低,其主要原因是________________________________。
【考型4】过氧化氢的性质
4.[15 天津,9]向粉碎的印刷电路板中加入H2O2,NH3和
NH4Cl溶液,反应后过滤,得到铜氨溶液和残渣。
(1)反应中H2O2的作用是___________________。
(2)NH4Cl在反应中的主要作用是______________________________________________。
【考型5】物质褪色与漂白作用
5.下列判断正确的是( )
A.[16 江苏,3]SO2具有氧化性,可用于漂白纸浆
B.[15上海,5]二氧化硫能使溴水褪色,不能说明二氧化硫具有漂白性
C.[17 北京,11]根据SO2通入酸性KMnO4溶液,紫色溶液褪色,说明 SO2有漂白性
D.[山东高考]Cl2、SO2均能使品红溶液褪色,说明二者均有氧化性
一、硫的性质
1.SO2与CO2性质的比较
在非氧化还原反应中,作为酸性氧化物,SO2与CO2化学性质相似:
2.单质硫在空气中燃烧
只能生成SO2不能生成SO3,SO2转化为SO3需要催化剂,或在空气中缓慢氧化。在标准状况下,SO3是固态,可用冰水冷却的方式分离SO2、SO3。
3.酸雨与钙基脱硫
(1)pH<5.6的雨水才称为酸雨;(2)H2SO4型酸雨的形成[SO2+H2O==H2SO3,2H2SO3+O2==2H2SO4],收集的酸雨的pH值,在一段时间内会减小;(3)煤中含有少量的硫,燃烧生成SO2污染环境,常在煤中加入少量CaO(或CaCO3)吸收SO2,总反应为![]()
4.浓硫酸与浓硝酸的强氧化性
在众多的氧化还原反应中两者性质相似。
(1)与大多数不活泼金属(如铜)反应
(2)常温下与金属铁、铝发生钝化
(3)与铁反应生成三价铁盐(铁过量则生成亚铁盐)
(4)制法相似:![]()
①N2![]()
②![]()
所以,在考试中常常结合起来。
5.*硫的含氧酸及其盐
硫的含氧酸及其盐种类众多,在高考实验中常作为考查的背景材料,硫的含氧酸及其代表物质归纳如下:
(1)简单酸系列:亚硫酸(H2SO3)、硫酸(H2SO4)
(2)硫代硫酸系列:硫代硫酸钠(Na2S2O3),H2SO4中的1个O被S替代。可以拆写成下列形式分析化学性质(后同):Na2SO3·S。
(3)过酸系列:过硫酸(H2SO5),H2SO4分子中的O原子被过氧根(O2-2)替代。拆写分析形式:H2O2·SO3。又如过二硫酸(H2S2O8)。拆写分析形式:H2O2·(SO3)2。
(4)焦酸系列:焦亚硫酸(H2S2O5),2个H2SO3脱去1个H2O形成,拆写分析形式:H2SO3·SO2。又如焦硫酸(H2S2O7),拆写分析形式:H2SO4·SO3。
(5)连酸系列:连二硫酸(H2S2O6),H2SO4分子中的1个-OH被-HSO3所替代形成连二硫酸(H2S2O6)。拆写分析形式:H2SO4·SO2。
具体应用见实验的有关部分。
二、酸性气体与盐溶液反应能否生成沉淀的讨论
I中,由于对应的钡盐,虽不溶于水,却能溶于强酸,反应不能进行,如:CO2+H2O+BaCl2≠BaCO3↓+2HCl
Ⅱ中,由于反应在碱性条件下,生成的酸被碱中和,反应能生成对应的钡盐沉淀,如:CO2+BaCl2+2NH3·H2O==BaCO3↓+2NH4Cl。
Ⅲ中,SO2溶于水生成H2SO3,在Ba(NO3)2溶液中形成HNO3环境,将SO2氧化成SO42-,进一步生成BaSO4沉淀,如:3SO2+2H2O+3Ba2++2NO3-==3BaSO4↓+2NO↑+4H+;H2S能发生类似反应,CO2不发生该反应。
三、过氧化氢(H2O2)
1.强氧化性
如溶解Cu:H2O2+Cu+2H+==Cu2++2H2O
过氧化氢被称为“绿色氧化剂”,还原产物是水,对环境无污染,不产生新杂质。
2.弱还原性
H2O2遇强氧化剂时表现为还原性:2KMnO4+5H2O2+3H2SO4==K2SO4+2MnSO4+5O2↑+8H2O(用于定量测定H2O2或KMnO4的浓度)。
3.不稳定性
(1)H2O2参与反应,温度不能过高,否则会导致H2O2的分解,在工业流程的试题中,常涉及该点知识。
(2)除去溶液中过量的H2O2常用加热的方法。
(3)除MnO2作催化剂外,还有Cu2+、Fe3+等。
四、三类褪色与两种漂白
物质褪色主要有下列三类情况:
1.物理褪色:萃取褪色,活性炭吸附褪色。
2.一般反应褪色:如SO2使KMnO4溶液紫色褪去,盐酸使红色酚酞试液褪色。
3.漂白褪色:漂白一定是使有机色质褪色,如有色指示剂、品红、色素等,分为氧化漂白,化合漂白(褪色不等于漂白)。
两种漂白性的比较
SO2通常用于漂白纸张,使品红褪色等,不能用于漂白食物。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




