【高考化学·考试大纲】(1)了解常见铁及其重要化合物的制备方法,掌握其主要性质及其应用。(2)了解有关铁合金的概念及其重要应用。
【课程标准·学业要求】(1)能列举、描述、辨识典型铁及其化合物重要的物理和化学性质及实验现象。(2)能用化学方程式、离子方程式正确表示典型铁及其化合物的主要化学性质。
1.[双选]下列判断正确的是( )
A.[16 全国Ⅲ,7]铁比铜金属性强,不能解释FeCl3腐蚀Cu刻制印刷电路板
B.[15 全国Ⅰ,10]将稀硝酸加入过量铁粉中,充分反应后滴加KSCN溶液,有气体生成,溶液呈血红,说明稀硝酸将Fe氧化为Fe3+
C.[15 全国Ⅰ,10]将铜粉加入Fe2(SO4)3溶液中,溶液变蓝、有黑色固体出现,说明金属铁比铜活泼
D.[14 全国Ⅰ,8]FeCl3溶液可用于铜质印刷线路板制,原因是FeCl3能从含Cu2+的溶液中置换出铜
E.[18 全国Ⅱ,13]探究维生素C的还原性:可通过向盛有2mL黄色氯化铁溶液的试管中滴加浓的维生素C溶液,观察颜色变化,达到实验目的
2.[18 全国Ⅱ,28]在含有FeO和Fe2O3的混合物中,检验Fe2O3存在的方法是:________________。
3.[16 全国Ⅲ,36]铁锈的主要成分为_________。
4.[17 全国Ⅲ,26]在试管中加入少量绿矾(FeSO4·7H2O)样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由此可知:______________、_______________。
5.[16 全国Ⅱ,28]FeCl2溶液与氯水反应的离子方程式____________________________________。
6.[17 全国Ⅱ,26]水泥的主要成分为CaO、SiO2,并含有一定量的铁、铝和镁等金属的氧化物。在分解水泥样品过程中,以盐酸为溶剂,氯化铵为助溶剂,还需加入几滴硝酸。加入硝酸的目的是____________________________________,还可使用___________代替硝酸。
7.[16 全国Ⅱ,28]某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量FeCl3、FeCl2固体,均配制成0.1mol/L的溶液,在FeCl2溶液中需加入少量铁屑,其目的是。
(2)甲组同学取2mLFeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为____________________________________。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2mLFeCl2溶液中先加入0.5mL煤油,再于液面下依次加入几滴氯水和l滴KSCN溶液,溶液变红,煤油的作用是__________________。
(4)丙组同学取10mL0.1mol/L KI溶液,加入6mL0.1mol/LFeCl3溶液混合。分别取2mL此溶液于3支试管中进行如下实验:
①第一支试管中加入1mLCCl4充分振荡、静置,CCl4层呈紫色;②第二支试管中加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀;③第三支试管中加入1滴KSCN溶液,溶液变红。实验②检验的离子是_______(填离子符号);实验①和③说明:在I-过量的情况下,溶液中仍含有______(填离子符号),由此可以证明该氧化还原反应为_________________________。
8.[18 全国Ⅱ,28]用K3[Fe(C2O4)3]·3H2O作感光剂,以K3[Fe(CN)6]溶液为显色剂,可用于晒制蓝图。晒制蓝图时,其光解反应的化学方程式为:
显色反应的化学方程式为_________________。
一、铁及其重要化合物的性质
1.铁的性质
铁元素通常显___和___价,且___价更稳定。
铁属于活泼的金属,在自然界中只有_____形式,如磁铁矿(化学式______),赤铁矿(化学式______)等。
(1)物理性质:被磁铁吸引,银白色金属(铁粉为黑色),纯铁的熔点______,防腐能力强。但是通常炼制出的铁合金中含有____等杂质,使铁的熔点降低(合金的性质),容易锈蚀(原电池原理)。
(2)化学性质
与非金属单质反应
铁丝在氧气中燃烧:![]() _____
_____
★红热的铁与水蒸气反应:
上述是生成Fe3O4的两个重要反应,考试常以生成Fe2O3设陷阱。
Fe与Cl2、Br2等强氧化剂反应,生成Fe(Ⅲ),化学方程式分别为:![]() ______;
______;
过量的铁丝在氯气中燃烧,只生成______,不生成FeCl2;
则氧化性:Br2___S(填“>”或“<”)。
Fe与H+(非氧化性酸)、I2、S、Cu2+、Fe3+反应,生成Fe(Ⅱ),化学方程式分别为:
Fe+2H+==_______;
Fe+I2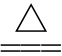 ____________;Fe+S
____________;Fe+S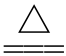 __________
__________
Fe+CuSO4==___________;Fe+2FeCl3==_________
铁与浓硫酸或浓硝酸,常温下发生“_____”。
2.铁的氧化物性质比较
3.铁的氢氧化物性质比较
*4.铁的变价转换
5.铁及其化合物的用途
(1)氧化铁能制作红色涂料。(2)Fe3+的净水作用。(3)补血的药物。
二、铁元素价类二维转化
【考型1】Fe2+与Fe3+的检验
1-1.下列判断正确的是( )
A.[15 天津,2]在溶液中加KSCN,溶液显红色,证明原溶液中有Fe3+,无Fe2+
B.[14 四川,4]检验Fe(NO3)2晶体是否已氧化变质的操作:将Fe(NO3)2样品溶于稀硫酸后,滴加KSCN溶液,观察溶液是否变红
C.[15 广东,22]向FeSO4溶液中先滴入KSCN溶液,再滴加H2O2溶液,观察到加入H2O2后溶液变成血红色,说明Fe2+有还原性
1-2.[15上海,7]检验用硫酸亚铁制得的硫酸铁中是否含有硫酸亚铁,可选用的试剂是[双选]( )
A.K3[Fe(CN)6] B.KMnO4 C.KSCN D.苯酚(https://www.xing528.com)
【考型2】Fe2+与Fe3+的性质与及相互转化
2-1.下列判断正确的是[双选]( )
A.[16 江苏,5]向Fe2(SO4)3溶液中加入过量铁粉:Fe3++Fe==2Fe2+
B.[14 广东,22]将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡,静置,下层溶液显紫红色,说明氧化性:Fe3+>I2
C.[14 江苏,4]氧化铁能与酸反应,所以可用于制作红色涂料
D.[17.4 浙江,学6]氯化铁溶液可用于制作印刷铜电路板
2-2.[17.11 江,学28]在硬质玻璃管中进行加热条件下铁与水蒸的反应,实验后,取硬质玻璃管中适量的固体,用一定浓度的盐酸溶解,滴加KSCN溶液,没有出现血红色,说明该固体中没有+3价的铁,判断结论是否正确并说明理由_______________________________________________________________________。
【考型3】Fe(OH)2的制备与实验方案的设计
3.判断正误。[15 重庆,4]通过右图实验,观察Fe(OH)2的生成( )
一、Fe2+与Fe3+的检验
1.Fe3+的检验
(1)题干叙述:呈黄色溶液;
(2)特征检验Fe3+最典型的方法:与KSCN溶液反应。现象:溶液变为(血)红色[Fe(SCN)3](注意不是沉淀)。
(3)化学性质分析:
①与NaOH溶液反应,现象:生成红褐色沉淀。
②与KI溶液反应:2Fe3++2I-==2Fe2++I2
a.与KI淀粉溶液(试纸),现象:变成蓝色。
b.与KI溶液反应,再加入CCl4充分振荡、静置,CCl4层呈紫色。
③加入Cu片;现象:铜片被腐蚀,溶液变成蓝绿色(Fe2+、Cu2+混合色)。2Fe3++Cu==2Fe2++Cu2+
2.Fe2+的检验
(1)题干判断:溶液呈浅绿色。
(2)检验Fe2+最典型的特征方法:与K3Fe(CN)6反应;现象:生成蓝色沉淀。
(3)化学性质分析:
①滴加少量酸性KMnO4溶液反应。现象:KMnO4溶液紫色褪去,常用于排除含有Fe3+干扰的溶液中。
②与NaOH溶液反应。现象:生成白色沉淀,沉淀迅速变成灰绿色,最后变成红褐色,不能用于含有Fe3+干扰的溶液。
③加入溴水(或氯水)溶液。现象:溴水褪色,可用于排除含有Fe3+干扰的溶液中。
④先加入KSCN溶液,无明显变化,再加入H2O2(或氯水),溶液显红色。注意加入药品的先后顺序不能颠倒。不能用于含有Fe3+干扰的溶液。
二、Fe2+与Fe3+的性质与及相互转化
1.“考铁考变价”
这是铁元素在考试中的重要功用!在考试中凡遇考铁及其化合物,要特别分清两种价态的铁元素。
(1)Fe2+与Fe3+的氧化还原性强弱顺序:
氧化性:Cl2>Br2>Fe3+>Cu2+>I2>Fe2+
还原性:Cl-<Br-<Fe2+<Cu<I-<S2-
(2)过量的铁对氧化产物的影响
①Fe(NO3)2溶液的隐形氧化:向Fe(NO3)2溶液中加入稀硫酸,形成硝酸环境,会氧化Fe2+。②废铁屑表面上常有铁锈生成,并附有油污,预处理废铁屑的方法:酸洗去除铁锈;热碱洗涤除去油污。
2.FeCl3腐蚀Cu刻制印刷电路板的讨论
(1)离子反应:Cu+2Fe3+==Cu2++2Fe2+,现象:溶液由黄色变为蓝绿色。
(2)该反应不是置换反应,只能证明还原性Cu>Fe2+,不能说明金属性Fe>Cu;比较金属性的强弱是通过溶液中的置换反应Fe+Cu2+==Fe2++Cu来证明。
3.Fe2+、Fe3+离子的水解与溶液的配制
(1)Fe2+、Fe3+离子在溶液中均水解使溶液呈酸性,在pH为4左右Fe3+离子完全水解生成Fe(OH)3沉淀,在pH为9左右Fe2+离子完全水解生成Fe(OH)2沉淀,所以Fe3+离子在近中性溶液中不能稳定存在。
(2)含Fe2+、Fe3+离子溶液的配制要点
①配制FeCl3溶液时先将FeCl3固体溶于浓盐酸中(抑制FeCl3水解,防止生成沉淀而导致溶液变浑浊),再加水稀释至所需浓度。
②配制FeCl2溶液时,为防止Fe2+被空气氧化,还需加入少量铁粉。
4.高铁酸钾的性质
高铁酸钾(K2FeO4)中的Fe显+6价,它是一种高效复合水处理剂;(1)由于具有强氧化性,能杀菌、消毒。(2)由于反应后还原产物为Fe3+,Fe3+在溶液中水解生成氢氧化铁胶体,吸附水中的悬浮杂质,起到净水的作用。
三、氢氧化亚铁的制备与实验方案的设计
由于Fe(OH)2易被氧化为Fe(OH)3,考Fe(OH)2几乎都会涉及到被氧化成Fe(OH)3的性质考查。
实验室制取Fe(OH)2的关键是防止与O2接触,操作时注意下列两点:
1.溶液中溶解的O2必须除去:操作是将NaOH溶液加热煮沸,以驱除溶解的O2。
2.制备过程要确保生成的Fe(OH)2隔绝空气。操作方法:①滴加NaOH溶液的滴管末端插入液面下滴加。②在反应液面上滴煤油或苯等物质进行液封,以隔绝空气。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




