【高考化学·考试大纲】(1)了解化学的主要特点是在原子、分子水平上认识物质。了解化学可以识别、改变和创造分子。(2)物质的组成、性质和分类:①了解分子、原子、离子和原子团等概念的含义。②理解混合物和纯净物、单质和化合物、金属和非金属的概念。③理解酸、碱、盐、氧化物的概念及其相互联系。④熟记并正确书写常见元素的名称、符号、离子符号。⑤熟悉常见元素的化合价。能根据化合价正确书写化学式(分子式),或根据化学式判断元素的化合价。(3)溶液:①了解溶液的含义。②了解溶解度、饱和溶液的概念。③了解胶体是一种常见的分散系,了解溶液和胶体的区别。
【课程标准·学业要求】(1)能依据物质类别和元素价态列举某种元素的典型代表物。(2)能举例说明胶体的典型特征。
1.下列叙述正确的是( )
A.[18 全国I,10]16.25gFeCl3水解形成的Fe(OH)3胶体粒子数为0.1NA
B.[18 全国Ⅱ,8]雾和霾的分散剂相同
2.[18 全国Ⅲ,27]KIO3的化学名称是_______。
3.[16 全国Ⅱ,26]联氨为二元弱碱,在水中的电离方式与氨相似。联氨(N2H4)与硫酸形成的酸式盐的化学式为_______。
4.[14 全国Ⅰ,27](1)H3PO2是一元中强酸,写出其电离方程式:_______________________________。
(2)NaH2PO2为________(填“正盐”或“酸式盐”)。
一、物质的组成
1.元素、物质及微粒间的关系
(1)宏观上物质是由_____组成的,微观上物质是由_____________________________________________________构成的。
(2)元素:具有____________的一类原子的总称。
(3)元素的存在形态
①游离态:元素以_______形式存在的状态。
②化合态:元素以_______形式存在的状态。
2.同素异形体
(1)_______________________叫同素异形体。
如氧的同素异形体有O2和O3;碳的同素异形体有:金刚石、石墨、C60和石墨烯等。
(2)同素异形体之间的性质差异主要体现在_______性质上,同素异形体之间的转化属于 变化。
3.混合物和纯净物
(1)纯净物:由__________________组成的物质。
(2)混合物:由几种不同的单质或化合物组成的物质。
二、物质的分类
见下栏表:
几个容易出现的误区:
(1)误认为:“由相同元素组成的物质一定是纯净物”。例如:单质可能是同素异形体的混合物,O2、O3组成混合气体;化合物可能是同分异构体,如C4H10的结构有正丁烷和异丁烷;元素相同但可能形成化合物的比例不同,H2O、H2O2组成混合物。
(2)误认为:“溶液呈酸性的物质一定是酸,溶液呈碱性的物质一定是碱”。例如:
①NaHSO4、CuSO4、NH4Cl溶液呈酸性,它们均属盐,苯酚也显弱酸性,但不划归为酸。
②Na2CO3、NaHCO3溶液呈碱性,它们均属盐。
三、氧化物的分类
氧化物:由两种元素组成,其中一种是氧元素的化合物。
1.酸性氧化物:酸性氧化物+→盐+水(反应前后元素化合价不变)。
2.碱性氧化物:碱性氧化物+→盐+水(反应前后元素化合价不变)。
3.两性氧化物:既能与反应,也能与反应生成盐和水的氧化物。如:Al2O3、*ZnO(两性氧化物)。
4.不成盐氧化物:既不能与酸反应,也不能与碱反应生成(相应价态的)盐和水的氧化物。例如:NO、CO等。
5.过氧化物:含有过氧基-O-O-的化合物。例如:H2O2、Na2O2、CaO2等。
氧化物类别判断的三个注意点:
(1)酸性氧化物不一定是非金属氧化物,如Mn2O7;非金属氧化物也不一定是酸性氧化物,如NO、CO、NO2、H2O。
(2)碱性氧化物一定是金属氧化物,但金属氧化物不一定是碱性氧化物,如Mn2O7是酸性氧化物,Al2O3属于两性氧化物,Na2O2是过氧化物。
(3)酸性氧化物、碱性氧化物形成对应酸、碱时,中心元素化合价不变。酸性氧化物也就是对应价态酸的酸酐。
四、分散系
1.分散系的概念
一种或几种物质分散到另一种物质中形成的_____叫做分散系。被分散的物质叫做,能分散分散质的物质叫做。
2.分散系的分类(https://www.xing528.com)
3.溶液
一种或几种物质分散到另一种物质里,形成______、________的混合物。溶液由、组成。
4.胶体
(1)概念:分散质直径在之间的分散系(胶体的本质特征)。
(2)常见的胶体:Fe(OH)3胶体、淀粉溶液、稀豆浆、肥皂液、蛋白质溶液、血液、Al(OH)3胶体、硅酸胶体。
(3)胶体的性质:(丁达尔效应)光束通过胶体时形成一条光亮的“通路”,用于鉴别胶体和。
(4)溶液、胶体、浊液比较
几种分散系的比较
特别提醒:
①胶体与其他分散系的本质区别:胶体粒子的直径在1~100nm之间,这是胶体的本质特征,也是胶体区别于其他分散系的依据,同时也决定了胶体的性质。
②胶体属于分散系,是混合物,而很多纳米级物质的微粒直径也是在1~100nm之间,但不属于胶体,属于纯净物,如纳米铜等。烟和雾分别是以固体或液体分散在空气中形成的气溶胶。
③区分胶体和溶液的最简单方法为丁达尔效应,分离胶体和溶液的操作是渗析。丁达尔效应与渗析都是物理变化,不是化学变化。
④氢氧化铁胶体中的胶粒不是指1个Fe(OH)3“分子”,而是很多Fe(OH)3“分子”聚集在一起形成的直径在1~100nm之间的集合体。这点常在关于NA的选择题中进行考查。
【考型1】物质的分类
1.[14 四川,2]下列关于物质分类的说法正确的是( )
A.金刚石、白磷都属于单质
B.漂白粉、石英都属于纯净物
C.氯化铵、次氯酸都属于强电解质
D.葡萄糖、蛋白质都属于高分子化合物
【考型2】胶体的性质
2.下列判断不正确的是( )
A.[18 江苏测试,19]用丁达尔效应鉴别Al(OH)3胶体和Na2SO4溶液
B.[17 江苏测试,16]用激光笔照射CuSO4溶液可产生“丁达尔效应”
C.[18 江苏,6]KAl(SO4)2·12H2O溶于水可形成Al(OH)3胶体
D.[18.4 浙江,学6]氢氧化铁胶体可用作净水剂
一、物质的分类
1.交叉分类法 从不同角度对物质进行分类。例如:
2.树状分类法
按不同层次对物质进行逐级分类,各层之间属于包含关系。例如:
二、胶体
1.★Fe(OH)3溶胶的制备
取一个小烧杯,加入20mL蒸馏水,加热至沸腾,然后向沸水中滴加FeCl3饱和溶液5~6滴,继续煮沸,待溶液呈红褐色后,停止加热。反应方程式:FeCl3+3H2O===△Fe(OH)3(胶体)+3HCl。
2.胶体的性质
有丁达尔效应。胶体微粒能通过滤纸,不能用过滤的方法分离提纯胶体。
3.胶体的净水作用
吸附水中悬浮杂质,常用于净水的有Al(OH)3胶体、Fe(OH)3胶体、硅酸胶体。
三、化学式的变式写法
有时通过改变化学式的书写形式,更有助力于帮助理解物质的性质,如硅酸盐。例如:
Cu2(OH)2CO3→Cu(OH)2·CuCO3;H4N2O3→NH4NO3
Fe3O4→FeO·Fe2O3;Pb3O4→2PbO·PbO2;
NH3·H3BO3→NH4BO2·H2O(属于正盐)
Al(OH)3(碱式写法)→HAlO2·H2O(酸式写法)
NaHSO4→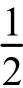 [H2SO4·Na2SO4]
[H2SO4·Na2SO4]
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




