【高考化学·考试大纲】了解阿伏加德罗常数(NA)的含义。能根据微粒(原子、分子、离子等)物质的量、数目、气体体积(标况下)之间的相互关系进行有关计算。
【课程标准·学业要求】运用物质的量、摩尔质量、气体摩尔体积、物质的量浓度之间的相互关系进行简单计算。
●下列题中NA均表示阿伏加德罗常数的值。
1.[18 全国I,10]下列说法正确的是( )
A.16.25gFeCl3水解形成的Fe(OH)3胶体粒子数为0.1NA
B.22.4L(标准状况)氩气含有的质子数为18NA
C.92.0g甘油(丙三醇)中含有羟基数为1.0NA
D.1.0molCH4与Cl2在光照下反应生成的CH3Cl分子数为1.0NA
2.[18 全国Ⅱ,11]下列说法正确的是( )
A.常温常压下,124gP4中所含P—P键数目为4NA
B.100mL 1mol·L-1FeCl3溶液中所含Fe3+的数目为0.1NA
C.标准状况下,11.2L甲烷和乙烯混合物中含氢原子数目为2NA
D.密闭容器中,2molSO2和1molO2催化反应后分子总数为2NA
3.[17 全国Ⅱ,8]下列说法正确的是( )
A.1L 0.1mol·L-1NH4Cl溶液中,NH4+的数量为0.1NA
B.2.4gMg与H2SO4完全反应,转移的电子数为0.1NA
C.标准状况下,2.24L N2和O2的混合气体中分子数为0.2NA
D.0.1molH2和0.1molI2于密闭容器中充分反应后,其分子总数为0.2NA
4.[17 全国Ⅲ,10]下列说法正确的是( )
A.0.1mol的11B中,含有0.6NA个中子
B.pH=1的H3PO4溶液中,含有0.1NA个H+
C.2.24L(标准状况)苯在O2中完全燃烧,得到0.6NA个CO2分子
D.密闭容器中1molPCl3与1molCl2反应制备PCl5(g),增加2NA个P-Cl键
5.[16 全国Ⅰ,8]下列有关叙述正确的是( )
A.14g乙烯和丙烯混合气体中的氢原子数为2NA
B.1molN2与3molH2反应生成的NH3分子数为2NA
C.1molFe溶于过量硝酸,电子转移数为2NA
D.标准状况下,2.24L CCl4含有的共价键数为0.4NA]
●下列题中NA均表示阿伏加德罗常数的值。
【考型1】标况下气体摩尔体积与粒子数的计算
1-1.下列叙述正确的是( )
A.[18 全国I,10]22.4L(标准状况)氩气含有的质子数为18NA
B.[17 全国Ⅲ,10]2.24L(标准状况)苯在O2中完全燃烧,得到0.6NA个CO2分子
C.[16 全国Ⅰ,8]标准状况下,2.24L CCl4含有的共价键数为0.4NA]
D.[14 广东,10]标准状况下,22.4L氨水含有NA个NH3分子
1-2.[双选]下列叙述正确的是( )
A.[15 广东,10]标准状况下,22.4L N2和H2混合气中含NA个分子
B.[14 江苏,6]标准状况下,11.2L苯中含有分子的数目为0.5NA
C.[16 四川,4]标准状况下,5.6L CO2气体中含有氧原子数为0.5NA
D.[16 江苏测试,16]常温常压下,11.2L O2中含有的原子数目为NA
【考型2】一定物质或反应中目标微粒数目的计算
2-1.下列叙述正确的是(多选)( )
A.[14 全国,7]1molNa2O2固体中含离子总数为4NA
B.[14 四川,5]高温下,0.2molFe与足量水蒸气反应,生成的H2分子数目为0.3NA
C.[14 四川,5]室温下,1LpH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA
D.[17.11 浙江,学22]amol的R2+(R的核内中子数为N,质量数为A)的核外电子数为a(A-N-2)NA
2-2.下列叙述正确的是( )
A.[18 海南,9]18g的D2O中含有的质子数为10NA
B.[18.4 浙江,学20]10g的2H216O中含有的质子数与中子数均为5NA
C.[17.4 浙江,学22]1L 0.1mol·L-1硫酸钠溶液中含有的氧原子数为0.4NA
【考型3】混合物中微粒数的计算
3-1.下列叙述不正确的是( )
A.[18 全国Ⅱ,11]标准状况下,11.2L甲烷和乙烯混合物中含氢原子数目为2NA
B.[14 全国,7]丙烯和环丙烷组成的42g混合气体中氢原子的个数为6NA
C.[14 江苏,6]1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA
D.[15 全国Ⅰ,8]18gD2O和18gH2O中含有的质子数均为10NA
3-2.下列叙述不正确的是( )
A.[18 海南,9]28g的乙烯和环己烷混合气体中所含原子总数为12NA
B.[15 四川,5]2.0gH218O与D2O的混合物中所含中子数为NA
C.[17 海南,9]1mol的CO和N2混合气体中含有的质子数为14NA
D.[17.4 浙江,学22]0.1mol乙烯与乙醇的混合物完全燃烧所消耗的氧分子数为0.3NA
【考型4】可逆反应或平衡体系中粒子数的分析
4-1.下列叙述正确的是( )
A.[14 广东,10]56g铁片投入足量浓硫酸中生成NA个SO2分子
B.[15 广东,10]1molCu和足量热浓硫酸反应可生成NA个SO3分子
C.[17.4 浙江,学22]0.1molKI与0.1molFeCl3在溶液中反应转移的电子数为0.1NA
D.[15 全国Ⅰ,8]2L 0.5mol·L-1亚硫酸溶液中含有的H+数小于2NA
4-2.下列叙述正确的是( )
A.[15 广东,10]23gNa与足量H2O反应完全后可生成NA个H2分子(https://www.xing528.com)
B.[17 海南,9]1L 0.1mol·L-1的乙酸溶液中含H+的数量小于0.1NA
C.[15 四川,5]50mL12mol·L-1盐酸与足量MnO2共热,转移的电子数为0.3NA
D.[14 全国,7]2L 0.5mol·L-1硫酸钾溶液中阴离子所带电荷数为NA
【考型5】反应中电子转移数的计算
5-1.下列叙述正确的是( )
A.[15 四川,5]标准状况下,5.6L CO2与足量Na2O2反应转移的电子数为0.5NA
B.[14 全国,7]1molFeI2与足量氯气反应时转移的电子数为2NA
C.[15 广东,10]3mol单质Fe完全转变为Fe3O4,失去8NA个电子
D.[14 四川,5]氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA
5-2.下列叙述不正确的是( )
A.[17.11 浙江,学22]含0.2molH2SO4的浓硫酸与足量的镁反应,转移电子数大于0.2NA
B.[17 海南,9]1mol甲烷完全燃烧转移的电子数为8NA
C.[15 全国Ⅱ,10]235g核素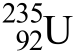 发生裂变反应:
发生裂变反应: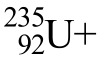
![]() 净产生的中子(10n)数为10NA
净产生的中子(10n)数为10NA
D.[15 全国Ⅱ,10]23g钠在空气中充分燃烧时转移电子数为1NA
E.[15 全国Ⅰ,8]过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA
【考型6】化学键的计算
6-1.[双选]下列叙述正确的是( )
A.[15 四川,5]常温常压下,4.4g乙醛所含C-H键数目为0.5NA
B.[17 海南,9]1mol乙烯分子中含有的碳氢键数为4NA
C.[14 江苏,6]0.1mol丙烯酸中含有双键的数目为0.1NA
D.[14 广东,10]1mol甲苯含有8NA个C-H键
6-2.下列叙述正确的是( )
A.[15 全国Ⅱ,10]60g丙醇中存在的共价键总数为10NA
B.[17.11 浙江,学22]任意条件下,1mol苯中含有C-H键的数目一定为6NA
C.[16 四川,4]氢原子数为0.4NA的CH3OH分子中含有的共价键数为0.4NA
D.[18 海南,9]12g金刚石中含有化学键的数目为4NA
有关NA微粒的正误判断是常考题型,解题时要“先分析后计算”,只有当分析都正确后才进行计算,否则盲目地引入计算,常常是错误判断的根源;可从下列三个方面分析:
(1)概念指代是否正确,如盐酸溶液叙述HCl分子,苯分子中含有的C=C等都是概念的错误。
(2)前提条件是否具备,如用22.4L·L-1计算时,条件是标准状况和气态。
(3)原理分析是否正确,如可逆反应按完全反应分析的错误。
一、标况下气体摩尔体积与粒子数的计算
题给体积为22.4L及其倍数是考查标准况下气体摩尔体积(22.4L·L-1)与粒子数计算的标志。
思维顺序(用气二查):给出体积→要用“22.4L·L-1”解题→查是否为“标准状况”和“气态”。
(1)条件要为标准状况(273K,1.01×105Pa或0℃、101kPa)。(2)讨论的物质要处于气态。在标况下不为气体的常考物质有:H2O(l)、SO3、NO2、HF、CCl4、CHCl3(氯仿)、CH3OH、C6H6(苯)、己烷、碳原子数大于4的烃等。(3)当已知的是气体的“物质的量或质量”等进行计算时,与体积无关,则无需外界条件。
忽略“标准状况”和“物质不为气态”常是命题人设置的陷阱。
二、一定物质或反应中目标微粒数目的计算
1.思维顺序:计算题给物质的物质的量→分析目标微粒与该物质的数量关系→得出目标微粒(原子数、核外电子数、中子数、质子数等)的物质的量。
2.注意辨析所求微粒的构成数目:
(1)分子中的原子个数:He(单原子)、O3(臭氧)、P4(白磷)、C60、S8。(2)常见微粒的电子数:10电子微粒(NH+4、NH-2、OH-、H2O、NH3、CH4);等电子体(N2与CO含电子数为14e-);基团(-CH3与-OH含电子数为9e-)。(3)离子化合物晶体中的离子数,如阳离子:阴离子[Na2O(2:1)、Na2O2(2:1)、NaHSO4(1:1)]。(4)同位素原子中的中子数、质子数和相对原子质量,旭D2、18O2、D2O、H37Cl等。D(即21H)相对原子质量为2,D2O的相对分子质量是20。
三、混合物中微粒数的计算
常用极端思维法(极值法)分析,当讨论的混合物分别处于极端纯物质时,看所求微粒数是否相等;若相等,则无论以何种比例混合,只要总量一定,所求量为一个定值,这个值可用极端思维法求出的值代替,如2.0gH218O与D2O的混合物中含中子数是否为NA:先分别分析2.0gH218O和D2O所含的中子数,结果都为NA,则H218O与D2O无论以何种比例混合,只要总质量为2.0g,则所含的中子数都相等,且为NA。该类分析有如下两种常见情况:
1.题给“混合物的质量一定”时
(1)一种情况是分析各混合物的最简式,看是否相同,若相同,无论以何种比例混合,含最简式微粒的数目不变,以最简式为准来进行计算。常考最简式相同的物质有:O2与O3(同素异形体)、NO2与N2O4;最简式为CH2的分子(C2H4、C3H6和CnH2n)。
(2)另一种情况是分析各混合物的相对分子质量,看是否相同,若相同,无论与何种比例混合,含分子的数目不变。常考的相对分子质量相等的物质有:CO、N2、C2H4等。
2.题给“物质的量一定”时
分析混合物质的组成比例是否相同,若相同,无论以何种比例混合,目标微粒数目不变。常考的组成相似的物质有,Na2O2与Na2O(都由2个阳离子和1个阴离子构成)。
四、可逆反应或平衡体系中粒子数的计算
1.注意分析“前提、对象、概念”等是否正确
(1)计算溶液中的微粒数时,是否要用到溶液的体积:题给c(B)或pH值,计算(反应后)物质的微粒时,与溶液的体积有关。溶液等体积混合,体积相同时,不能理解成以1L溶液混合。
(2)微粒对象:计算H原子或O原子时,分清是指“溶质分子”,还是包括“溶剂中的水分子”等。
(3)H2SO4与pH值的混淆:由pH计算c(H+)与硫酸是二元酸无关,定义式pH=-lgc(H+);由c(H2SO4)计算c(H+)与硫酸是二元酸有关。
2.在可逆反应中由于存在平衡,反应不能进行到底,不能以完全反应来计算粒子数目
(1)化学平衡:注意如下典型的可逆反应(试题中不会提示)。①NO2在通常情况下,不可避免地要生成N2O4(2NO2 N2O4)。②N2与H2合成NH3。③SO2和O2的混合生成SO3。④NH3溶解于水生成NH3·H2O。⑤Cl2与H2O反应。⑥I2与H2反应生成HI等。“在密闭容器中”,是气体可逆反应的必备前提。
N2O4)。②N2与H2合成NH3。③SO2和O2的混合生成SO3。④NH3溶解于水生成NH3·H2O。⑤Cl2与H2O反应。⑥I2与H2反应生成HI等。“在密闭容器中”,是气体可逆反应的必备前提。
(2)弱电解质的电离:如NH3·H2O、CH3COOH、HClO等弱酸因部分电离,而使溶质分子数减少。
(3)水解平衡:如NH+4、ClO-等因发生水解反应而消耗,离子数目减少;Mg2+、Cu2+、Fe3+、Al3+、CO2-3等因发生水解反应而消耗,生成H+或OH-使溶液中阳离子或阴离子总数增多等。
(4)生成胶体:由于胶粒是小分子聚集而成,会导致胶体中的微粒数变化,如1molFe3+完全水解生成1molFe(OH)3,而nFe(OH)3→[Fe(OH)3]n(胶粒),故胶体微粒数目少于1NA。
(5)给出不能完全反应的物质的量,来诱错进行计算:如含1mol浓H2SO4与足量的铜反应,计算生成SO2的物质的量或电子转移的数目;含1molHCl的盐酸与足量的MnO2反应,计算生成Cl2的量,常温下铁与浓硫酸反应计算生成SO2等,都小于按完全反应计算的值。
考题中对不能确定反应程度的可逆反应,给出变化后某种粒子的确切数值,常是命题人设置的陷阱。
五、反应中电子转移数计算
(1)原理分析:如铁在反应中生成的是+2价还是+3价要分清(下例括号中为铁在反应产物中的化合价数):铁与硫粉(+2价)反应、在足量或不足量的氯气(+3价)中燃烧、与足量液溴(+3价),高温下与水蒸气反应生成Fe3O4;与过量的硝酸(+3价)、与少量的硝酸(+2价),与稀硫酸、盐酸(+2价),电极反应中(+2价)。
(2)歧化反应:1molNa2O2+H2O(或CO2)反应转移1mol电子,1molCl2+NaOH反应转移1mol电子(但1molCl2与水反应发生可逆反应转移电子小于1mol),1molNO2+H2O反应转移2/3mol电子。
(3)典型的几种分析:1molCl2只作氧化剂时转移2mol电子;1molNa与O2反应无论生成Na2O还是Na2O2时均转移1mol电子。
(4)反应中得电子总数与失电子总数相等:①不能把得电子数与失电子数相加进行计算。②计算时常以最容易的一种变化为准来计算电子转移数。
六、化学键的计算
半键法:化学式中各原子形成的价键数(一般来说为满足8或2电子结构需要多少电子就要形成几根键)之和除以2的商,即为1mol该物质中的共价键(共用电子对或“σ键+π键”的总数)的物质的量,示例:
(1)1molSiO2含4molSi-O,[Si为4键,O为2键,即![]() (2)1molSi含2molSi-Si,[即
(2)1molSi含2molSi-Si,[即![]() =2]。(3)1molP4含6molP-P,[即
=2]。(3)1molP4含6molP-P,[即![]() ]。(4)1molCnHmOx共价键数=
]。(4)1molCnHmOx共价键数=![]() =(2n+m/2+x)mol。
=(2n+m/2+x)mol。
半键法从数学角度回避了对具体物质结构的分析,不管是分子还是原子晶体,都可以用些法。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




