【高考化学·考试大纲】能正确书写化学方程式和离子方程式,并能进行有关计算。
【课程标准·学业要求】运用物质的量、摩尔质量、气体摩尔体积、物质的量浓度之间的相互关系进行简单计算。
1.[14 全国Ⅱ,9]下列反应中,反应后固体物质增重的是( )
A.氢气通过灼热的CuO粉末
B.二氧化碳通过Na2O2粉末
C.铝与Fe2O3发生铝热反应
D.将锌粒投入Cu(NO3)2溶液
2.[16 全国Ⅱ,26]联氨(N2H4)可用于处理高压锅炉水中的氧,防止锅炉被腐蚀。理论上1kg的联氨可除去水中溶解的O2_________kg。
3.[17 全国Ⅰ,26]取某甘氨酸(C2H5NO2)样品m克,将其中的氮转化成铵盐(NH3·H3BO3),然后用盐酸滴定进行测定(已知:NH3·H3BO3+HCl==NH4Cl+H3BO3),滴定时消耗浓度为cmol·L-1的盐酸VmL,则样品中氮的质量分数为_________%,样品的纯度≤_______%。
4.[17 全国Ⅱ,26]实验中称取0.400g水泥(主要成分为CaO、SiO2等)样品,将钙转变成草酸钙,草酸钙沉淀经稀H2SO4处理后,用KMnO4标准溶液滴定,通过测定草酸的量可间接获知钙的含量,滴定反应为MnO4-+H++H2C2O4→Mn2++CO2+H2O。滴定时消耗了0.0500mol·L-1KMnO4溶液36.00mL,则该水泥样品中钙的质量分数为_________。
5.[17 全国Ⅲ,27]某工厂用m1kg 铬铁矿粉(含Cr2O340%)制备K2Cr2O7,最终得到产品m2kg,产率为_________。
6.[14 全国Ⅱ,27]PbO2在加热过程发生分解的失重曲线如下图所示,已知失重曲线上的a点为样品失重4.0%(即![]() ×100%)的残留固体,若a点固体组成表示为PbOx或m PbO2·n PbO,列式计算x值___和m∶n值____。
×100%)的残留固体,若a点固体组成表示为PbOx或m PbO2·n PbO,列式计算x值___和m∶n值____。
一、化学方程式中有关量的关系
气体体积比(同条件下)2×22.4L:1×22.4L
1.各物质的化学计量数之比=粒子数之比=物质的量之比=各气体体积比;但不等于质量比。
2.可以选择不同的物理量进行计算[不设未知量时,有一套规范的符号表示,如物质的量用nB,质量用mB,气体体积用VB、溶液体积用V(aq)、微粒数用NB],列比例时要注意物理量及单位是:“上下单位统一,左右单位相当”。如上式中H2可以取不同的物理量,但必须是相关联的,即2molH2~2×22.4LH2~4gH2。
3.物质的量应用于化学方程式计算的一般格式:
(1)根据题意写出并配平化学方程式。
(2)依据题中所给信息及化学方程式判断过量物质,用完全反应时物质的有关数据进行计算。
(3)在化学方程式有关物质的化学式下面先写出已知物和所求物的有关量的关系,再代入已知量和所求量。
(4)写出所求物质的数学表达式。
(5)写出解答过程和答案。
二、质量守恒定律
1.概念:参加化学反应的物质的质量总和=反应后生成的物质的质量总和。注意关系词“质量总和”。
反应前后,物质的量可能相同也可能不相同,即不存在物质的量不一定守恒。(https://www.xing528.com)
2.实质:化学反应前后元素的种类和原子的个数不发生改变。
【考型1】化学方程式和化学式的计算
1-1[15 浙江,27]将4.80g甲加热至完全分解,得到金属钠和2.24L(折算成标准状况)的H2。甲的化学式。
1-2[15 山东,29]在空气中煅烧CoC2O4生成钴氧化物和CO2,测得充分煅烧后固体质量为2.41g,CO2体积为1.344L(标准状况),则钴氧化物的化学式为________。
【考型2】关系式法的计算
2.[17 北京,27]测定溶液中尿素[CO(NH2)2,M=60g·mol-1]含量的方法如下:取ag尿素溶液,将所含氮完全转化为NH3,所得NH3用过量的V1mLc1mol·L-1H2SO4溶液吸收完全,剩余H2SO4用V2mLc2mol·L-1NaOH溶液恰好中和,则尿素溶液中溶质的质量分数是。
【考型3】差量法
3.[17.11 浙江,学29]取7.90gKMnO4,加热分解后剩余固体7.42g。该剩余固体与足量的浓盐酸在加热条件下充分反应,生成单质气体A,产物中锰元素以Mn2+存在。请计算:
(1)KMnO4的分解率________;
(2)气体A的物质的量________。
【考型4】列方程组进行的混合物计算
4.[14 浙江,26]取10.80g某无机矿物盐X,将X在惰性气流中加热至完全分解,得到6.40g固体FeO和CaO的混合物和生成CO2。X的化学式是________,在惰性气流中加热X至完全分解的化学反应方程式为_____________________________________。
一、化学方程式列比例
最重要的基础方法,关键抓对应项列比例,且“上下单位统一,左右单位相当”。
二、关系式法
从原料到产品可能要经过若干步反应,前一反应的生成物是后一反应的反应物。列关系式通常有如下几种方法:(1)有关化学方程式的计量数关系;(2)原子守恒关系;(3)得失电子守恒关系。
列式计算,可以不用写出完整的化学方程式,是一种快速高效的计算方法。
注意事项:在多步反应中,每一步中的转化率、利用率及最后所得产品的纯度等,可以累积进行计算。
三、差量法
所谓“差量”就是指反应过程中反应物的某种物理量之和(始态量)与同一状态下生成物的相同物理量之和(终态量)的差,这种物理量可以是质量、物质的量、气体体积、气体压强、反应过程中的热效应等。根据化学方程式求出理论上的差值(理论差量),结合题中的条件求出或表示出实际的差值(实际差量),根据比例关系建立方程式并求出结果。
差量法的解题关键是找准研究对象。通常有:(1)固体的质量差,研究对象就是固体。(2)气体的质量差,研究对象就是气体。(3)液体的质量差,研究对象就是液体。
四、列方程组进行的混合物计算
计算中的数学思想:在两种物质组成的混合物中,一般可设两个未知数x、y,题目中通常也会给出两个已知量(设为A、B),寻找x、y与A、B的数学关系,由此建立二元一次方程组进行联解: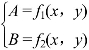
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




