化学实验教学前的物质准备主要是实验装置的准备和实验药品及其他实验用具的准备,为了保证课堂实验教学顺利展开,还必须做预备实验。
(1)实验装置的加工与组装
实验装置主要有气体发生和收集装置,如固-固加热反应制取难溶于水的气体实验装置(见图1-1)、液-固加热反应制取密度大于空气的气体实验装置(见图1-2);混合物分离装置,如蒸馏装置(见图1-3)、过滤装置(见图1-4)等。
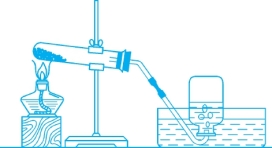
图1-1 固-固加热制取难溶于水的气体实验装置
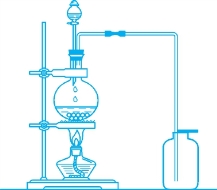
图1-2 液-固加热制取比空气密度大的气体实验装置

图1-3 一般蒸馏装置
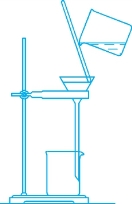
图1-4 过滤操作图示
在加工和组装时,为了保证实验现象达到预期的观察教学效果,所选用的各种仪器规格要比例协调;使用的玻璃管粗细要一致,弯管的角度及长度应适合实验的操作要求,使用方便;整套密闭性装置,各种仪器之间的连接要严密,气密性要好;凡是尾气有毒的实验一定要采用尾气吸收或处理装置。对易污染环境的实验要尽可能采用微型化装置。
(2)一般常用药品的配制或预处理
中学化学实验常用药品的配制主要指不同浓度酸、碱、盐的溶液配制,而药品的预处理主要指的是固态反应物在实验前的处理。例如,常用的3mol/L硫酸溶液的配制、酸碱指示剂试液的配制、氢气吹肥皂泡的肥皂水配制、碳还原氧化铜的碳粉与氧化铜的处理等。
①常见酸、碱、盐溶液的配制
配制酸、碱、盐溶液需要了解原酸、碱、盐的浓度和密度,然后才能根据所要配制溶液的浓度,计算确定溶质、溶剂的量,然后配制。表1-1是几种常见酸碱的密度和浓度。
表1-1 几种常见酸、碱的密度和浓度
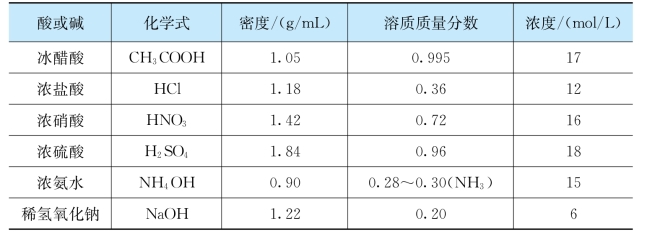
从表中数据可知,由市售浓溶液加水稀释可以配成各种所需要的溶液浓度。
例1 用浓盐酸配制2mol/L的稀盐酸溶液100mL。
计算:
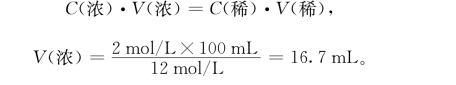 (https://www.xing528.com)
(https://www.xing528.com)
配制:用量筒量取约16.7mL的浓盐酸,倒入100mL的烧杯中,加入水至100mL刻度线,用玻璃棒搅拌溶解均匀,注入规格为100mL的试剂瓶中,贴好标签。
例2 用固体氢氧化钠配制50mL质量分数为20%的溶液(ω表示溶质的质量分数)。
计算:
![]()
![]()
配制:用50mL的烧杯放在托盘天平的左盘,称好质量,然后再加砝码与游码共12.2g,定量称氢氧化钠固体12.2g,取下烧杯,注入少量水搅拌溶解后再加水至50mL的刻度线,用玻璃棒搅拌溶解均匀,注入规格为50mL的试剂瓶中,贴好标签。
例3 配制40g质量分数为5%的NaCl溶液。
计算:
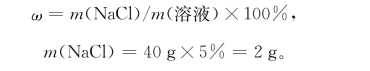
配制:用托盘天平称取NaCl2g,放入50mL的烧杯中,水的质量为38g(40g-2g),用量筒量取38mL水倒入烧杯,搅拌均匀,注入规格为50mL的试剂瓶中,贴好标签。
从上述配制过程可知,溶液配制的一般步骤为:计算—称量—溶解—装瓶。
要配制3mol/L硫酸溶液,可以将1体积的浓硫酸加水稀释至6体积即可。要配制3mol/L氨水溶液,则将1体积的浓氨水加水稀释至5体积。可见酸碱溶液稀释可以用溶液溶质质量分数的计算方法或物质的量浓度的计算方法,再按计算所得浓溶液与水的量配制,也可以用简单的体积比兑水稀释而成。这里介绍的是粗略的配制方法,若要准确配制,需用精确的称量器具,如移液管、容量瓶、分析天平等。
②常用酸碱指示剂试液的配制
酚酞(w为0.01)试液:溶解1g酚酞于90mL酒精与10mL水的混合液中。
石蕊试液:2g石蕊溶于50 mL水中,静置一昼夜后过滤,在溶液中加30mL95%的乙醇,再加水稀释至100mL。
③其他两种溶液的配制
淀粉(w为0.002)溶液:将0.2g可溶性淀粉和少量冷水调成糊状,倒入100mL沸水中,煮沸后冷却即可。
肥皂水溶液:用少量起泡效果较好的皂粉或洗头膏加水煮沸、搅拌,控制好溶液的浓度,充分溶解成稀胶状后冷却。
④固体反应物的处理
固体与固体反应通常要在干燥的情况下充分混合、加热才能反应完全。由于水分的存在会影响化学反应的速率,也会削弱催化剂的催化作用;充分混合才能使反应物较好地相互接触;加热可以提供反应所需要的能量。所以,有的固体反应物在实验前往往需要烘干并用研钵尽量碾细。
(3)预备实验
为了检验所组装的实验装置或配制的溶液是否符合实验演示的要求,应在课前做预备实验。在预备实验中了解实验所需要的时间、实验可能呈现的现象、考虑如何引导学生观察、组织讨论,检查实验用具是否完备、实验的安全性等。尽最大努力做到在课堂演示中万无一失。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




