【案例1】九年级化学(沪教版)第3章第1节“构成物质的基本微粒”教材分析
根据课程标准规定,本节主要包含四部分内容:一是认识物质的微粒性,知道分子、原子、离子等是构成物质的基本微粒,了解构成物质微粒的性质;二是知道分子、原子、离子等构成物质的基本微粒间可相互转化;三是知道原子的构成,初步认识核外电子在化学反应中的作用;四是结合微粒的性质及微粒间的转化等知识,运用微粒的观点解释某些常见的现象。
学习研究“微粒的性质”时,教材先后安排“你已经知道什么”“观察与思考(探究微粒运动实验)”“活动与探究(水与酒精混合、水和空气压缩实验)”等活动性栏目,三个栏目分别通过回忆提取、观察收集和实验获取关于构成物质微粒的相关事实现象,要求学生根据各种途径获取的事实现象推测微粒的性质(微粒在不停地运动、微粒之间都存在一定的空隙)并能解释微粒性质与相关事实现象(打开酒精瓶时会闻到酒精的气味、气体往往比液体更易被压缩、将红墨水滴加到水中整杯水会慢慢变红)之间的关系。
学习研究“原子的构成”时,教材设置了介绍1911年英国科学家卢瑟福“用α粒子轰击金箔”化学史实的“交流与讨论”栏目。栏目详细介绍用α粒子轰击金箔时的现象(大部分α粒子能够穿透金箔,而且不改变原来的前进方向,但也有一小部分α粒子改变了原来的运动路径,甚至有极少数的α粒子好像碰到了不可穿透的坚硬质点而被弹了回来),并要求学生“试着对上述实验现象进行解释”,并和同学交流、探讨自己的看法。最后,还通过“拓展视野”呈现了原子结构示意图。
这样的教材编写,呈现出多种类型的事实证据(如生产生活中的现象、实验现象、化学史实等),要求学生结合各种类型的事实证据作出合理的推论,从而认识微粒的相关性质、原子的初步结构等。同时,通过相关现象的解释、对原子结构认识想法的交流,建立证据与结论之间的关系。因此,本节内容很好地培养了学生的证据意识、利用证据进行推论并得出合理结论的能力以及建立证据与结论逻辑关系的能力。此外,原子结构示意图作为一种化学认识模型,在后续的学习(研究物质的性质、揭示元素周期律等)中起到很重要的作用。
这样的内容特点和编排要求,能很好地引导学生通过实验、观察并充分发挥想象等手段,结合具体的事实与现象,在猜想、推测与想象的基础上,知道构成物质的基本微粒、微粒的基本性质以及化学反应的微观本质,落实课程标准提出的“通过观察、想象、类比、模型化的方法使学生初步理解化学现象的本质”的要求。因此,本节对培育“证据推理与模型认知”学科核心素养具有重要的价值。
【案例2】“盐类的水解”(第一课时)
1.教学要求分析
“盐类的水解”安排在选择性必修《化学反应原理》模块“主题3:水溶液中的离子反应与平衡”中。根据“从……水溶液中的离子反应与平衡等方面,探索化学反应的规律及其应用”的模块定位可知,本课立足盐溶液中离子相互作用及其平衡的视角,帮助学生从系统、微粒和平衡的角度来理解盐类水解的基本原理,丰富对物质在水溶液中行为的认识,完善对化学变化规律的认识,认识到人们可以依据化学反应规律控制、利用化学反应等。
鲁科版教材“盐类的水解”(第一课时)以“盐溶液都显中性吗”的“活动·探究”栏目为切入点,引导学生分析盐溶液酸碱性、溶液系统中的微粒、微粒间的相互作用及溶液酸碱性等四个方面的逻辑关系,从而理解盐类水解的本质、总结盐类水解的规律并正确使用化学符号加以表征。其认知发展线索为:感知盐溶液并不一定呈中性—从微观视角理解盐类水解的本质—符号表征盐类水解的过程与结果—总结盐类水解的基本规律。显然,理解盐类水解的微观本质是基石,是掌握“盐类的水解”相关知识的核心与关键。
2.教学策略分析
如何帮助学生理解盐类水解的微观本质?关键在于引导学生结合前述四个方面逻辑关系的分析,建立起“宏观—微观”的联系,建构“溶液酸碱性—溶液中c(H+)及c(OH-)的关系—溶质微粒与溶剂微粒间相互作用”的推理思路及“溶质微粒与溶剂微粒间相互作用—溶液中c(H+)及c(OH-)的关系—溶液酸碱性”的认知思路。
推理思路的形成,既要基于具体的化学事实现象,又要通过更为广泛的事实现象加以检验。推理思路一旦被确认并达到熟练化水平,便成为研究化学事实现象的思考路径,进而转化为认识化学事实现象、解决化学问题的认知模型。因此,本课教学的关键在于:(1)为学生提供化学事实现象以引导学生开展分析活动并建构推理思路;(2)利用建构起来的推理思路去分析更多的化学问题,通过获取事实现象(证据)以验证推理思路的合理性和科学性;(3)形成正确的认识思路,并转化为认知模型去解决更多的化学问题。
结合“证据推理与模型认知”学科核心素养培育要求和前述分析,本课教学强调通过实验、问题、思考与交流来驱动学习,并采用图2-4-4所示的问题及实验序列来组织教学。
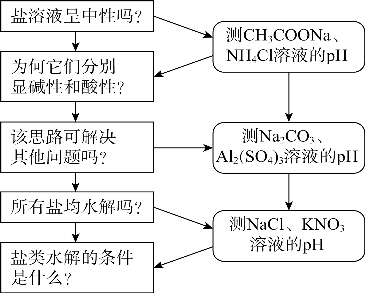
图2-4-4 “盐类的水解”教学流程
3.教学活动过程[22]
环节一 复习回顾
请同学们结合已有经验与知识,思考如下问题:
(1)纯水如何电离?常温下纯水中的c(H+)、c(OH-)大小关系如何?
(2)对于水溶液而言,溶液的酸碱性与溶液中c(H+)、c(OH-)大小有何关系?
(3)酸(或碱)溶于水后形成的溶液显酸(或碱)性,为什么?
设计意图:巩固学生对水的电离、溶液酸碱性与H+和OH-浓度大小关系的认识,为盐溶液的酸碱性分析奠定基础。
环节二 探究活动1
分析预测:现有0.1mol/L CH3COONa溶液。
(1)CH3COONa在水中如何电离?是否产生H+或OH-?
(2)CH3COONa溶液显酸性、中性还是碱性?为什么?
实验活动:用pH试纸测0.1mol/L CH3COONa的pH。(https://www.xing528.com)
分析反思:预测结果与真实结果为何不一致?
设计意图:引导学生利用已有经验开展预测活动,并通过实验感知预测和真实结果的差异,诱发认知冲突,激发探究兴趣。
环节三 探究活动2
实验活动:请重测CH3COONa溶液的pH,并用同样方法测0.1mol/L NH4Cl溶液的pH。将结果填入表中。

交流讨论:(1)结合醋酸钠溶液显碱性的实验事实,讨论如下问题:
①该溶液体系存在哪些电离过程?电离出哪些微粒?
②溶液中H+、OH-均来自水的电离,为何该溶液中c(H+)<c(OH-)?
(2)按前述醋酸钠溶液显碱性的分析思路,探讨NH4Cl溶液显酸性的原因。
(3)和同学交流讨论,并用自己的话语归纳总结盐溶液显酸性或碱性的原因。
设计意图:引导学生结合具体事实,在分析讨论基础上初步建立盐溶液酸碱性分析的基本思路,初步建立关于盐溶液体系中微粒间相互作用、水的电离平衡及移动、盐溶液的酸碱性等的整体性认识。
环节四 检验论证
交流讨论:(1)为何盐溶液体系中的盐电离出来的金属离子或酸根离子会与水电离出来的OH-或H+结合?你将如何证明?(2)根据你的分析,预测Na2CO3及Al2(SO4)3溶液的酸碱性,并从微观视角加以分析。
实验活动:(1)设计实验并验证盐溶液体系中盐电离出来的金属离子或酸根离子会与水电离出来的OH-或H+结合形成弱电解质;(2)用pH试纸测定0.1mol/L Na2CO3、Al2(SO4)3溶液的pH,并将实验结果与预测相对比。
设计意图:引导学生从弱电解质电离平衡的角度,认识溶液体系中弱碱的金属离子或弱酸根离子能与水电离产生的OH-或H+结合为弱电解质分子,形成对盐类水解微观本质的认识,并通过实验来验证这一认识的正确性。
环节五 探究活动3
思考分析:现有0.1mol/L NaCl、KNO3溶液,预测这两种溶液的pH,并从微观视角加以分析。
实验活动:用pH试纸检测上述两种溶液的pH。
交流讨论:(1)预测结果与实验结果是否一致?(2)若不一致,请分析其可能原因;(3)结合对前面六种盐溶液酸碱性的分析,总结盐溶液酸碱性的分析思路。
设计意图:通过呈现貌似“违背”盐类水解规律的案例,完善对盐类水解条件的认识,进一步深化对盐类水解本质的理解,完善从微观视角分析盐溶液酸碱性的认识思路。
环节六 迁移应用
提出问题:现有稀盐酸、氢氧化钠、硫酸钠、氯化铁及硅酸钠等溶液。
(1)哪些溶液显酸性?哪些溶液显中性?哪些溶液显碱性?
(2)以显酸性(或碱性)的溶液为例,从微观角度分析它们显酸性(或碱性)的原因。
(3)结合问题(2),总结可从哪些角度分析溶液的酸碱性。
(4)结合(3)的分析,总结在分析电解质溶液酸碱性时,哪些溶液只需考虑电解质的电离,哪些溶液需要同时考虑电解质和水的电离以及电离出来的微粒间的相互作用?
设计意图:对酸碱电离和盐类水解知识进行统整,学会从多角度分析溶液酸碱性,巩固对电离、水解等相关知识的认识。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




