【案例1】九年级化学(沪教版)第4章“认识化学变化”教材分析
“物质的化学变化”是初中化学重要的主题内容。这一主题包含化学变化的特征、化学反应的类型、化学反应中的能量变化、质量守恒定律、化学反应的表示等内容。该主题的学习,旨在帮助学生认识化学变化、认识化学变化规律、了解化学变化的研究方法,并逐步形成“物质可以变化”的观点。[16]为落实前述课程要求,上海教育出版社出版的九年级化学教材在前面三章的基础上,设置第4章“认识化学变化”,较为集中地安排本主题的相关内容。本章教材结构及内容如图2-3-3所示。[17]
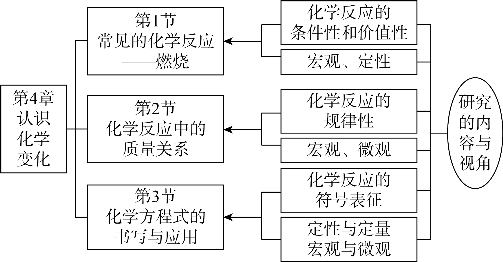
图2-3-3 “认识化学变化”教材结构与内容要求
本章各节内容及其学习要求为:
第1节“常见的化学反应——燃烧”,引导学生总结燃烧反应的特征与现象,总结燃烧的条件,认识燃烧反应的应用;同时,根据燃烧的条件学习完全燃烧与不完全燃烧、爆炸等相关知识,感知条件对化学反应的影响;最后,了解灭火方法,建立起燃烧的条件与灭火原理(方法)关系的认识,感知控制条件改变化学反应的价值。
第2节“化学反应中的质量关系”,引导学生开展化学反应中质量关系的研究,并从微观层面上认识质量守恒的原因,进一步深化化学反应中元素不变的认识,建立起化学反应规律性的认识,从而更好地利用反应规律分析解决问题,服务于人类的生产生活实践活动。
第3节“化学方程式的书写与应用”,引导学生学习使用符号系统表征化学反应,系统认识化学反应的条件性、规律性,认识化学方程式表达化学反应的间接性、完整性和通用性,帮助学生建立起化学学习领域中“宏观—微观—符号”三重表征的联系及其转化。在正确书写化学方程式、理解化学方程式质和量关系的基础上,学会定量处理化学反应中物质间量的关系,理解化学方程式计算的本质依据,了解化学计算的科学本质,认识定量研究对化学科学发展的意义。
不难看出,“认识化学变化”这一章的学习,强调从定性与定量、宏观与微观、文字与符号的角度,认识化学反应的条件性、化学反应的规律性以及化学方程式等,建立起对化学反应的多角度、整体性认识。因此,该主题很好地引导学生认识物质的运动和变化,知道化学变化需要一定的条件并遵循一定规律,认识化学变化伴随物质变化和能量转化,认识化学变化的可调控性等,从而培育变化观、守恒观和能量观等学科基本观念。
【案例2】“化学平衡”教学设计[18]
对于化学平衡的学习,不仅能够帮助学生认识化学变化具有一定的限度,而且能够让学生理解化学反应是可以根据需要调控的。选择性必修阶段还引入化学平衡常数,促进学生对化学平衡的认识上升到定量水平。当建立起对化学平衡状态的定量认识时,学生就可以多角度、动态地分析化学变化。因此,这一内容很好地引导学生建立“化学平衡观”,建立预测化学平衡状态、分析化学平衡移动等问题的基本思路,从而培育学生“变化观念与平衡思想”素养。
如何优化教学以达成此素养培育?这就需要教师能够认识到化学平衡常数不仅仅是一个概念、一个表达式,它具有十分丰富的认识功能。主要体现在:基于化学平衡常数K,不仅可以通过某一组分浓度改变来定性判断平衡状态,还可以在多组分浓度变化的情况下根据浓度变化值定量分析化学平衡;能建立同一可逆反应不同平衡状态之间的关系,能建立平衡状态之间的关联认识;能体会同一反应在同一温度下可以有多种平衡状态,认识到平衡状态时一旦某一组分浓度发生改变,其他组分的浓度都将发生相应的改变来构建新的平衡。同时,引入浓度商Q概念,帮助学生基于Q、K关系定量地描述平衡的动态建立过程,体会Q、K关系对平衡状态的决定性作用。因此,选择性必修阶段引入化学平衡常数K(和浓度商Q)后,将能促进学生对平衡状态的认识取得突破性发展。为发挥平衡常数K的认识功能以促进学生素养发展,可设计如下教学思路:
阶段一 引入与回顾
接触法制硫酸时,二氧化硫催化氧化反应为:2SO2(g)+O2(g 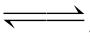 2SO3(g)。某温度下,反应体系中各物质浓度随时间的变化数据如下表:
2SO3(g)。某温度下,反应体系中各物质浓度随时间的变化数据如下表:
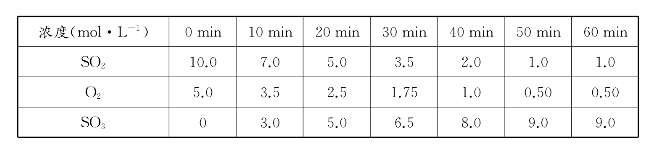
提出问题:(1)上述反应能否进行到底?(2)如何判断上述反应到达平衡状态?
设计意图:通过呈现二氧化硫催化氧化的c-t数据表格,帮助学生直观感受到可逆反应存在反应限度;同时,引导学生回顾必修阶段学习中判断平衡状态的方法——浓度不随时间改变,激发学生已有的知识经验,为进一步学习铺垫。
阶段二 初识化学平衡常数
提出问题:如何预测反应何时平衡?平衡时各物质浓度是否有规律可循?
环节1 学生寻找平衡规律
呈现温度为800℃时,在不同投料下,反应CO(g)+H2O(g) H2(g)+CO2(g)起始与平衡各物质浓度的4组数据。讨论:这些数据反映了化学平衡具有怎样的特点?
H2(g)+CO2(g)起始与平衡各物质浓度的4组数据。讨论:这些数据反映了化学平衡具有怎样的特点?
 (https://www.xing528.com)
(https://www.xing528.com)
设计意图:引导学生感知数据的变化规律,探寻利用“浓度商”来表征化学平衡,感知处于平衡状态的可逆反应,“浓度商”是一个定值,从而初步建立起浓度与平衡状态的定量认识。
环节2 平衡规律试推广
呈现温度为457.6℃时,不同投料下H2与I2化合时各物质初始与平衡浓度的4组数据。讨论:第一环节建立起的认识,是否所有的化学平衡都遵循?如果不遵循,还需如何进一步完善?

设计意图:通过分析,认识到对于含系数的可逆反应,用“浓度商”表达化学平衡时,需要根据系数进行幂次方运算。
环节3 总结化学平衡规律,提出反应限度、平衡常数K的概念
设计意图:自主探究化学平衡规律,发现并推导得出平衡常数表达式。自主建立概念使学生记忆深刻,对规律的认知也更深入,加深对平衡常数重要性的认识。
阶段三 化学平衡常数特征的分析
1.数据观察:CO(g)+H2O(g) H2(g)+CO2(g)在不同条件下的K值。
H2(g)+CO2(g)在不同条件下的K值。

2.得出结论:对于特定反应,K 只与温度有关,不受初始浓度、是否使用催化剂等影响。
设计意图:从具体可逆反应的平衡常数出发,直观感受平衡常数的特征,增进对平衡常数的理解,了解使用平衡常数描述化学平衡需注意的问题。
阶段四 认识化学平衡常数意义
提出浓度商概念,并挖掘平衡常数K的意义:
(1)预判可逆反应状态:Q=K,平衡;Q<K,反应正向进行;Q>K,反应逆向进行。
(2)描述平衡的建立过程:Q不断趋向K的过程即平衡的建立过程。
(3)表征同类型反应进行的难易程度(结合25℃时卤化氢合成反应的K值来说明)

设计意图:提出浓度商概念,从Q、K关系理解平衡状态、平衡建立过程。进一步感受平衡常数的价值,实现对平衡状态的理论预测,对平衡状态的认识上升到理性高度。
环节4 反应限度与平衡状态的关系
讨论:对某一个特定的可逆反应,在同一温度下,是否只有一个反应限度?该反应限度是否只对应一个平衡状态?
设计意图:体会反应限度与平衡状态的关系,认识到同一反应在同一温度下可以有多种平衡状态,建立起不同平衡状态之间的关联性认识,实现对反应限度与平衡常数K的关联性认识。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




