贾林立
初三化学是化学学科的入门,我们既要培养学生的学习兴趣,又要让学生具备一定的技能,以便到了高中可以成功过渡,进行深入学习。作为初高中衔接的一个重要知识点——差量法,是必须要掌握的技能之一。而且,差量法虽然只是一种计算方法,但它在各种题型中都会出现,简单的计算题,难度较大的还可以用于混合物成分分析题,更可用于实验题当中,让学生去分析实验进行的程度、最后生成物的可能性等。因此,此方法简直就像一把解题的“万能钥匙”,下面我们将分步骤介绍打造这把“万能钥匙”的方法。
(一)分析历年中考考题,摸准考试动向
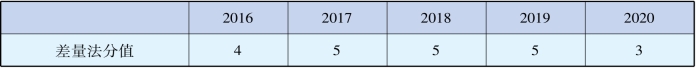
《孙子兵法》中有一句话:“知己知彼,百战不殆”。要想成功学会此方法并灵活运用,我们可以先来了解一下此知识点在中考题中如何考查。我们把近几年的柳州市中考化学的相关考题做了一个分析,如表3-8。从表格中我们不难看出,出题者年年都有考查此知识点,足以证明它的重要性。
表3-8 2016—2020年柳州市中考差量法分值表
(二)循序渐进,以不变应万变
经过上面的分析可以发现,差量法这个知识点简直就像是一条“变色龙”,可以任意地出现在各种题目之中。如果想要学生学会这个方法,并能进行很好地运用,我们应该如何去教授呢?下面将循序渐进地把差量法分为三个梯度来进行介绍。
1.反应前后的质量之差就是某物质的质量
第一种最简单,一般会出现在最后一道计算大题中。在讲解质量守恒定律新课过程中,可以不断强化、巩固。
解题关键:根据质量守恒定律,反应前物质的质量总和等于反应后物质的质量总和。若反应前后有某个物质的状态不一样,那物质反应前后的质量总和的差值就是这个“特殊”状态的物质了。
例1:实验室用8gKMnO4分解制氧气,反应后称得固体物质的质量为7.2g,则剩余固体物质的成分是( )
A.K2MnO4和MnO2 B.KMnO4和K2MnO4
C.KMnO4 D.KMnO4、K2MnO4和MnO2
解析:本题的难度系数0.8,是一道入门级别的题目,难度并不大。依据反应前后物质质量相等可知,8g-7.2g=0.8g就是跑走的氧气的质量。因为不知反应是否完全,所以8g和7.2g的这两个数据都不可以直接代入方程式计算求解。下面开始代入数据计算:
解:设需要KMnO4的质量为X。
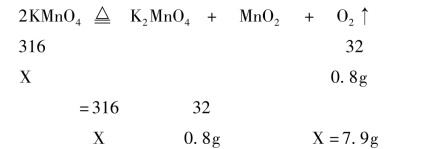
所求出的KMnO4的质量为7.9g小于题目中的8g,所以得知反应后剩余的固体中还有KMnO4剩余,所以答案应选D。
这种类型的题目难度不大,但是对于此类题目,老师一定要让学生熟练掌握,因为这是后面难题的基础。学生必须熟练掌握理解此类题型,才能很好地过渡到下一阶段。
2.反应前后的质量之差就是某物质中某元素的质量
第二种题目难度已经开始增大,一般会出现在第六单元,一氧化碳还原氧化铜。
答题关键:固体反应前后的质量之差就是金属氧化物中氧元素的质量。
例2:用氢气还原10gCuO,加热片刻后,冷却称得剩余固体物质量为8.4g,则参加反应的CuO的质量是多少克?
解析:本题的难度系数0.5,此题难度已经开始增大,有些同学听懂了,但是下次再遇到变式题目还是不会。要想解决此题,应从本反应的原理入手。氢气与氧化铜发生反应生成铜和水。在反应中氢气夺取氧化铜中的氧元素生成水,氧化铜失去氧元素后变成铜。题目中的10gCuO是否完全参加反应,仅通过题目的信息并不确定。反应后的8.4g固体物质量,全部是铜还是铜和氧化铜的混合物,我们也无法从题面得知。一切还是要通过计算才可以确定。那10g-8.4g=1.6g是谁的质量呢?通过之前的原理分析可知:是参加反应的氧化铜中氧元素的质量。我们下面开始代入数据计算:
解:设参加反应的氧化铜的质量为X。

由此可见,10g的氧化铜并不是全部参加反应。反应后的8.4g固体中还有一部分氧化铜剩余。
此类题目的原理还是显而易见的,教师讲题时千万不要就题论题,应多举一反三,才能帮助学生更好地掌握。
3.反应前后的质量之差就是参加反应的某物质中某元素的质量之差
到了第三类题目,难度已经开始增大,此类题目的考查方式会很多,变式一般也是千变万化,但是万变不离其宗。下面我们一起通过例题分析。(https://www.xing528.com)
例3:在托盘天平两端的烧杯中分别盛有足量的稀硫酸,此时天平平衡。若向左盘烧杯中加入11.2g铁粉,若要使天平最终仍保持平衡,应向右盘的烧杯中加入多少克锌粉?
解析:许多同学一看到本题,就没有思路。本题先要知道锌、铁与硫酸反应的原理,光是这一点要求一些同学就掌握得不扎实。对于一些基础相对好的同学而言,虽然掌握了基础,但是很容易掉入本题的陷阱。他们通常会用11.2g的铁粉求出生成氢气的质量,再用氢气的质量反过来求解锌粉的质量,但是这个思路离正确答案其实就只差了一步。让我们一起再来看看本题。若要天平保持平衡,关键应该是左右两边进入和出去的物质质量差相等,注意,是质量差相等。下面,开始计算:
解:设11.2g铁粉反应生成氢气的质量为X。
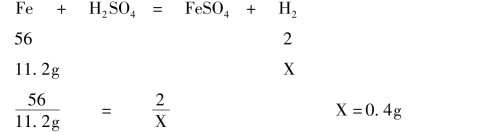
左盘的增重的实际质量为11.2g-0.4g=10.8g,而此质量应等于右边增重的实际质量。
设锌的质量为Y。
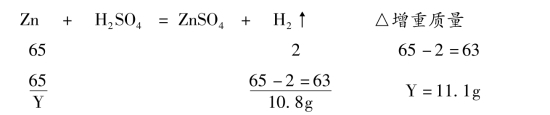
解析:本题难度系数0.2,能解决此类题目的学生能力已经相当高了。为了帮助更多的同学也能拿下此类题目,教师可以结合图像帮助学生。
要想拿下此类知识点,光是通过这几步还是不够的,同学们还要多多练习,分类小结,不要被表象迷惑,相信你也可以变成“计算高手”。
差量法是化学研究中常用的思维方法,也是化学解题中常用的技巧与策略。我们通过以上层层递进的例题训练不难发现:差量法不仅可以省去繁杂的中间计算过程,而且还可以消除无关量的影响,使复杂的问题简单、快捷化,同时也对学生的思维能力进行了有效考查。
四、引导学生自主探究,培育化学核心素养——以“质量守恒定律”为例
陈 欣
(一)背景介绍
为什么要培养学生的核心素养呢?核心素养是专为解决“应试教育”的弊端而提出的。传统的应试教育,学生以应付考试为主,通过记忆来获得知识,这些记忆通常呈现散点式,没有形成结构化的知识系统,且不具备迁移和实际应用的能力,在遇到真实问题时不能得到真正的发挥和利用。所以,我们要切实地将学生的知识转化为素养,在课堂教学中教会学生如何进行知识的迁移,提高学生解决实际中未知问题的能力。
化学学科的核心素养包括“宏观辨识与微观探析”“变化观念与平衡思想”“证据推理与模型认知”“科学探究与创新意识”“科学精神与社会责任”五个维度,教师要将核心素养的培育融入教学环节的设计中才能切实提高学生的能力。在教学过程中引导学生进行自主探究活动,在活动中通过设计实验、合作探究、反思交流等,可以最大限度地促进学生核心素养的养成。下面以《质量守恒定律》为例,探讨如何在探究活动中培养学生的化学核心素养。
(二)教学过程设计
课标指出,初中化学教育是启蒙教育,教师的重要工作就是引导学生认识和探究身边常见的化学物质,了解化学变化的一些奥秘。《质量守恒定律》是义务教育课程标准人教版化学教科书九年级上册第五单元课题1《质量守恒定律》的第1课时,内容有质量守恒定律的定义、为什么反应中质量会守恒以及对于这个内容的应用。
《质量守恒定律》一课非常重要,它的应用贯穿于整个中学化学。它让学生从微观和量的角度,重新认识化学反应,它是后续学习的理论基础。学好了这个定律,学生才会分析反应中物质的质量会如何变、变多少,而这也是化学核心素养的要求。这节课的实验设计也很多,很适合将核心素养融入实验设计和探究活动中。
整节课要让学生在“兴趣、探究、实践”的氛围中学习,以新课程课标作准绳,在活动中引导学生建立新旧知识间的联系,教会学生知识迁移,在教学中倡导自主、合作、探究的学习模式。让学生从传统的简单地跟教师学,到能够自己设计实验、自己动手实验探究,并在活动中发现问题、提出问题,最后在小组合作和教师的帮助下解决发现的问题。
具体设计内容见表3-9。
表3-9 《质量守恒定律》教学设计中体现的核心素养表
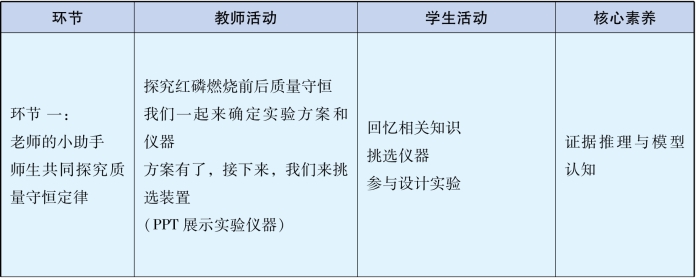
续 表
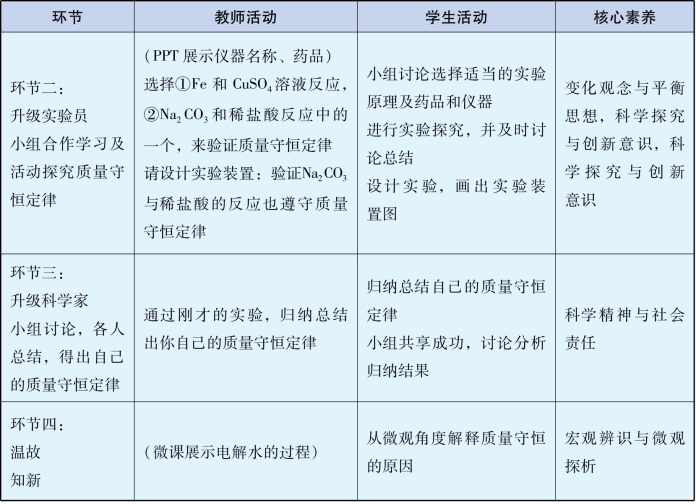
我们在不断总结教学过程和效果时发现:自主探究学习是最能够培育学生核心素养的一种教学模式。学生在课堂的实验探究过程中,必须运用所学知识完成探究任务,由学到用,由个人到合作,极大地提高了学生学习的主动性,其核心素养能力得到了很大的提升。
因此,要提高学生的核心素养,就要充分创造条件让学生自主学习合作探究。除了创造不同的实验条件让学生去探究,我们还可以鼓励学生在老师的帮助下,把在课堂中学到的知识点制作成微课,厘清宏观物质和微观粒子之间的联系和转化过程。
(三)教学成效反思
核心素养的培育不是一朝一夕就能轻松完成的,需要我们深刻理解培育核心素养的根本原因,以及切实将核心素养的培育融入日常的教学过程中。
每次课后教师及时进行随堂检测,在检测过程中发现学生对知识的掌握情况,知识点不再需要机械地记忆,学生也在实验探究中通过对知识的迁移和应用,对知识有了更深刻的理解。能够利用守恒的思想设计自己的实验装置,在核心素养和能力上得到了真正的提升。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




