蛋白质处于不断的降解与更新的过程中,其降解是一个受严密调控的极其复杂的过程,泛素在这一过程中的作用如同“死亡标签”,它会寻找那些无用的蛋白质,“贴”在这些蛋白质上,然后把这些无用的蛋白质送到“垃圾处理场”——蛋白酶体,最后把这些蛋白质消灭掉.左图即为泛素分子结构示意图.泛素是由76个氨基酸构成的多肽链,因其广泛分布于真核细胞而得名.
知能概述
2.复分解反应:两种化合物互相交换成分生成另外两种化合物的反应.
3.H+,OH-,Cu2+,Fe3+,![]() 的检验方法:
的检验方法:
根据反应中的现象及生成物的特征进行检验,如:
铵盐与熟石灰混合研磨有刺激性氨味的气体产生,可证明化合物中含有 ,为铵盐,可用于检验铵态氮肥.
,为铵盐,可用于检验铵态氮肥.
活泼金属与盐溶液反应时,先与水反应生成碱,再与盐发生反应.
有沉淀、气体、水生成,复分解反应才能完成.
问题解决
例1 复分解反应是我们学过的化学基本反应类型之一.学习时,应注意将知识进行归纳、总结,深刻理解复分解反应发生的条件,形成完整的知识体系.
(1)写出下列反应的化学方程式:
①氯化钡溶液与硫酸钠混合______________________________________;
②碳酸钾溶液与稀盐酸混合_____________________________________;
③氢氧化钡溶液与稀硝酸混合____________________________________.
(2)你想过上述复分解反应为什么能够发生吗?这是因为在这些反应物中含有一些“特殊”的阴、阳离子,它们能相互结合.如上述反应①中,实际参加反应的离子是Ba2+和 ,而Cl-,Na+则是“旁观者”,并没有参加反应.请你分析上述反应②中实际参加反应的离子是_________;上述反应③中实际参加反应的离子是________.
,而Cl-,Na+则是“旁观者”,并没有参加反应.请你分析上述反应②中实际参加反应的离子是_________;上述反应③中实际参加反应的离子是________.
(3)请根据你的想象,在下图右边的容器中画出体现NaOH溶液和稀盐酸反应的产物的示意图.
例1图
(山西省竞赛题)
解题思路 复分解反应能否发生的关键是反应物能溶于水或酸,生成物之一是沉淀、气体或水,如NaCl溶液与KNO3溶液混合,反应就不可能发生,因为反应既无气体、沉淀,也无水生成.上述反应中①有沉淀生成,②有气体生成,③有水生成,所以复分解反应可以发生.
例2 在“创新实验装置”的竞赛中,某化学兴趣小组设计了如图1所示的装置(夹持仪器已略去),引起同学们的兴趣.图2是四位同学对实验中的部分现象进行的预测,预测正确的是( ).
例2图1
例2图2
(山西省中考题)
解题思路 预测现象要依据相应的化学原理,装置①的二氧化锰是H2O2分解的催化剂,而催化剂在化学反应前后质量和化学性质均不会发生改变,①中产生的氧气进入②中,使②中气压增大,将NaOH溶液压入③中,则②中的溶液液面会下降,而③中由于发生2NaOH+CuSO4 Cu(OH)2↓+Na2SO4的反应,③中有蓝色沉淀生成.
Cu(OH)2↓+Na2SO4的反应,③中有蓝色沉淀生成.
例3 室温下,在pH=1的溶液中可能大量共存的是( ).
(上海市竞赛题)
解题思路 离子共存则互相不能发生反应生成沉淀、气体或难电离的水,如Ba2+与 可生成沉淀,
可生成沉淀, 在pH=1的酸性条件可生成气体,而H+与OH-则可生成难电离的水,以上三种状况下离子均不可共存.
在pH=1的酸性条件可生成气体,而H+与OH-则可生成难电离的水,以上三种状况下离子均不可共存.
例4 某同学设计如下几组实验,探究某些酸、碱、盐之间的复分解反应能否发生.
已知:BaSO4是白色固体,难溶于水,也不与盐酸反应.
【第一组】选取5种溶液,如图所示进行实验.
【第二组】对试管A和B中是否发生反应再探究,如图所示进行实验.
【第三组】对试管F中是否发生反应继续探究,如图所示进行实验.
(2019年江苏省苏州市中考题)
解题思路 稀硫酸与碳酸钠的反应方程式如下:
离子方程式如下:
因此试管C中的现象及何种离子减少就一目了然了.
酸、碱、盐之间的复分解反应通常可用离子方程式来表示.如试管E中:![]() ;而试管H中反应的实质为:
;而试管H中反应的实质为:![]() ,化学方程式为:
,化学方程式为:![]()
例5 已知BaCl2溶液和KHCO3溶液反应产生沉淀,小红同学为表示这个反应写了两个方程式:
①BaCl2+2KHCO3 BaCO3↓+2KCl+CO2↑+H2O;
BaCO3↓+2KCl+CO2↑+H2O;
②BaCl2+KHCO3 BaCO3↓+KCl+HCl.
BaCO3↓+KCl+HCl.
你认为她写的反应方程式中第________个是不合理的,理由是_______.
(江苏省竞赛题)
解题思路 BaCO3不溶于水,但是溶于盐酸,反应②中有盐酸生成,则不可能同时有BaCO3生成.
1.对盐的组成叙述正确的是( ).
A.都含有非金属元素 B.都含有金属元素
C.都不含有氢元素 D.都含有原子团
(上海市中考题)
2.某干粉灭火器的填充剂中含有磷酸二氢铵(化学式为NH4H2PO4).已知23.0g磷酸二氢铵加热完全分解得到固体物质X,5.4g水蒸气和3.4g氨气.固体物质X既不能燃烧也不能支持燃烧.下列说法错误的是( ).
A.磷酸二氢铵属于复合肥料
B.用磷酸二氢铵灭火既可降低温度,又可隔绝空气
C.固体物质X属于氧化物
D.该反应中固体物质X与氨气的分子个数比为2∶1
(2019年湖北省武汉市中考题)
3.晋代葛洪的《食肉方》(去除黑痣的药方)中记载:“取白炭灰(石灰)、荻灰(草木灰)等分煎合……可去黑痣.”起到“食肉”作用的主要物质是( ).
A.碳酸钙 B.熟石灰 C.碳酸钾 D.苛性钾
(全国复赛题)
4.化学肥料和农药对农业的高产丰收具有重要作用.下列有关说法错误的是( ).
A.KNO3是复合肥料
B.化肥能提高粮食产量,施用越多越好
C.熟石灰可用于改良酸性土壤
D.残留农药可通过农作物转移到人体中
(广东省广州市中考题)
5.同学们在做实验时发现,将镁条放入某CuCl2溶液中,镁条表面有气泡产生.对于这一“异常现象”产生的原因,同学们设计了以下探究方案进行讨论.其中没有意义的是( ).
A.甲同学推测该气体可能是H2,于是收集气体并检验该气体
B.乙同学猜想该CuCl2溶液呈酸性,并用pH试纸检测
C.丙同学用锌粒与该CuCl2溶液反应,观察是否有气泡产生
D.丁同学用镁粉与该CuCl2溶液反应,观察产生气泡的快慢
(湖北省竞赛题)
盐是由金属离子或铵根离子(NH+4)与酸根离子构成的化合物.由NH+4与酸根离子形成的盐为铵盐.
草木灰的主要成分是K2CO3,苛性钾是氢氧化钾的俗称.根据反应的化学方程式知:
K2CO3+Ca(OH)2 CaCO3↓+2KOH,所以“食肉”即是用强碱KOH去除黑痣.
CaCO3↓+2KOH,所以“食肉”即是用强碱KOH去除黑痣.
合理使用化肥能收到良好的经济、社会效益,否则会造成土壤板结、水体富营养化等恶果.
CuCl2在溶液中可与水反应生成少量酸,这类反应称作盐类的水解.
6.下列固体杂质不能用稀盐酸除去的是( ).
A.装氧化铜粉末后留下的黑色固体
B.铜器表面的铜绿[碱式碳酸铜:Cu2(OH)2CO3]
C.用澄清石灰水检验CO2后留下的白色固体
D.用氯化钡试液检验硫酸后留下的白色固体
(广东省中山市竞赛题)
7.氯化铵是一种常见的化肥,其水溶液显酸性.下列有关氯化铵的说法不正确的是( ).
A.它是一种氮肥
B.可使农作物枝叶生长茂盛
C.能与碱性肥料混合使用
D.用与熟石灰混合研磨的方法进行检验
(宁夏回族自治区中考题)
8.化学肥料是农作物的“粮食”.下列关于化学肥料的说法正确的是( ).
A.尿素[CO(NH2)2]属于复合肥料(https://www.xing528.com)
B.大量施用化肥可以提高农作物产量
C.铵态氮肥与草木灰混用,会降低肥效
D.棉花叶片枯黄,应施用硫酸钾等钾肥
(2019年广东省中考题)
9.某白色粉末可能含有碳酸钠、硫酸钠、硫酸钾、氯化钾、氢氧化钡中的一种或几种,为了探究其成分,小王同学按照如图所示流程进行了实验:
关于该实验有以下说法:
①步骤Ⅱ中沉淀全部溶解.则原白色粉末一定有氢氧化钡、碳酸钠,可能有氯化钾
②步骤Ⅱ中沉淀部分溶解,则原白色粉末一定有氢氧化钡、碳酸钠、硫酸钾
③步骤Ⅱ中沉淀不溶解.则原白色粉末一定有氢氧化钡,一定没有碳酸钠
④步骤Ⅱ中沉淀部分溶解,则原白色粉末的组成可能有3种情况
以上说法中正确的个数是( ).
第9题图
A.1个 B.2个 C.3个 D.4个
(云南省昆明市中考题)
BaCl2+H2SO4 BaSO4↓+2HCl BaSO4既不溶于水,也不溶于稀盐酸和稀硝酸.
BaSO4↓+2HCl BaSO4既不溶于水,也不溶于稀盐酸和稀硝酸.
含有 的盐与碱反应有氨气产生,这是检验
的盐与碱反应有氨气产生,这是检验 的方法.
的方法.
(NH4)2SO4+Ca(OH)2 CaSO4+2H2O+2NH3↑
CaSO4+2H2O+2NH3↑
这是复分解反应,反应中的氨气与水由NH3·H2O(一水合氨)分解得到.
结晶水合物在加热时会逐步地失去部分或全部结晶水.
10.电导率传感器可辅助探究复分解反应的实质.相同条件下,离子浓度越大,电导率越大,溶液导电性越强.将含有酚酞的Ba(OH)2溶液平均分成两份,置于两个烧杯中,并插入电导率传感器,往其中一份滴加稀硫酸,往另一份滴加硫酸钠溶液,测得溶液的电导率变化如图所示.下列说法正确的是( ).
第10题图
A.乙曲线电导率减小过程中,溶液由红色变为无色
B.乙曲线对应的反应中四种离子数目都减少
C.甲曲线对应氢氧化钡与硫酸钠反应
D.甲曲线上的M点代表两种溶液恰好完全反应
(2019年贵州省贵阳市中考题)
11.“粗盐提纯”的实验内容和步骤如下,下列说法错误的是( ).
第11题图
A.本实验需查阅资料,了解食盐在室温时的溶解度
B.操作Ⅲ中,若未能充分溶解,则实验的产率将偏低
C.操作Ⅳ中,得到的滤渣是粗盐中的难溶性杂质
D.操作Ⅴ中,需加热至液体蒸干为止
(上海市竞赛题)
12.为鉴别碳酸氢铵、氯化铵和尿素三种化肥,分别取三种样品编号为A,B,C并进行如下实验:
第12题图
(1)请分别写出A,B,C所对应化肥的化学式.
(2)请指出三种化肥的含氮量由大到小的顺序.
(3)铵态氮肥遇碱产生氨气,氨气与雨水作用可形成“碱雨”.请写一个中和“碱雨”的化学方程式.
13.保险粉(化学式Na2S2O4)在工农业生产中有广泛的用途,Na2S2O4在碱性溶液中稳定,在中性和酸性溶液中极不稳定;在NaCl存在下,Na2S2O4在水中溶解度显著下降.Na2S2O4制备流程如下:
第13题图
(1)反应Ⅰ的原理为:Zn+2SO2 ZnS2O4,该反应类型为___________.
ZnS2O4,该反应类型为___________.
(2)反应Ⅱ为复分解反应,该反应的化学方程式为____________________.
尿素的化学式为CO(NH2)2.
设计实验,加入物质,进行反应,切记复分解反应完成的条件,否则不能达到设计目的.
复分解反应在反应前后未发生化合价变化,所以不是氧化还原反应.
(3)操作a的名称为__________.
(4)滤液中含有Na2S2O4,为使Na2S2O4结晶析出还需要加入少量NaOH的原因是__________,加入NaCl的原因是_______________.
(5)198gZn(OH)2理论上能得到Zn的质量为______________________.
(广东省广州市中考题)
14.如图所示是某同学鉴别NH4HCO3,NH4Cl,KCl三种化肥的过程,其中试剂甲和乙分别可能是__________.
第14题图
A.甲:熟石灰 乙:稀盐酸
B.甲:水 乙:氢氧化钠溶液
C.甲:氢氧化钡溶液 乙:水
D.甲:稀盐酸 乙:氯化钠溶液
(江苏省竞赛题)
15.某化学学习小组同学设计了如下学习思路,从微观角度进一步理解某些复分解反应的实质.
【练习】下列各组物质间均能反应:
(1)氢氧化钠溶液与稀硫酸 (2)氢氧化钠溶液和硫酸铜溶液
(3)碳酸钠溶液与足量盐酸 (4)碳酸钠溶液和氯化钡溶液
写出反应(2)的化学方程式:_______________________________________.
【质疑】从微观角度思考,上述复分解反应的实质是什么?
【讨论】反应(1)的实质是H+和OH-结合生成水;反应(2)的实质是________.
【小结】阴、阳离子结合生成_________、_______或水,是某些复分解反应的实质.
【应用】请在![]() 这三种离子中选择合适的离子填入下面“( )”中,使其形成一个复分解反应网络(图中直线相连的阴、阳离子之间能够两两结合发生反应).
这三种离子中选择合适的离子填入下面“( )”中,使其形成一个复分解反应网络(图中直线相连的阴、阳离子之间能够两两结合发生反应).
第15题图
(广东省竞赛题)
16.除去NaCl溶液中CaCl2,MgCl2,Na2SO4杂质的操作有:①加过量的NaOH溶液;②加过量的BaCl2溶液;③过滤;④加适量的盐酸;⑤加过量的Na2CO3溶液.[提示:Mg(OH)2,BaSO4,BaCO3难溶于水]
(1)以上操作合理的先后顺序为___________(数字序号不能重复使用).
(2)请写出BaCl2溶液与Na2SO4溶液反应的化学方程式.
(3)上述试剂中Na2CO3不能用K2CO3代替,请说明原因.
(河南省中考题)
例1 (1)①BaCl2+Na2SO4 BaSO4↓+2NaCl ②K2CO3+2HCl
BaSO4↓+2NaCl ②K2CO3+2HCl 2KCl+CO2↑+H2O③Ba(OH)2+2HNO3
2KCl+CO2↑+H2O③Ba(OH)2+2HNO3 Ba(NO3)2+2H2O (2)
Ba(NO3)2+2H2O (2)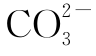 ,H+ OH-,H+ (3)
,H+ OH-,H+ (3)
例2 D
例3 C
例4 (1)气泡 (2)CO23- (3)H2SO4+BaCl2 BaSO4↓+2HCl (4)氢氧根离子与氢离子反应生成了水(或:H++OH-=H2O) (5)H+ (6)BaCl2
BaSO4↓+2HCl (4)氢氧根离子与氢离子反应生成了水(或:H++OH-=H2O) (5)H+ (6)BaCl2
例5 ② BaCO3与盐酸能剧烈反应,两者不能共存
1.A 2.D 3.D 4.B 5.D 6.D 7.C 8.C 9.B 10.D 11.D
12.(1)A为CO(NH2)2;B为NH4HCO3;C为NH4Cl
(2)尿素>氯化铵>碳酸氢铵
(3)NH3·H2O+HCl NH4Cl+H2O
NH4Cl+H2O
13.(1)化合反应 (2)2NaOH+ZnS2O4 Zn(OH)2↓+Na2S2O4 (3)过滤 (4)Na2S2O4在碱性溶液中稳定 降低Na2S2O4在水中的溶解度 (5)130g
Zn(OH)2↓+Na2S2O4 (3)过滤 (4)Na2S2O4在碱性溶液中稳定 降低Na2S2O4在水中的溶解度 (5)130g
14.A
15.【练习】2NaOH+CuSO4 Na2SO4+Cu(OH)2↓ 【讨论】OH-和Cu2+结合生成Cu(OH)2沉淀 【小结】气体 沉淀 【应用】
Na2SO4+Cu(OH)2↓ 【讨论】OH-和Cu2+结合生成Cu(OH)2沉淀 【小结】气体 沉淀 【应用】![]()
16.(1)②①⑤③④(或①②⑤③④) (2)BaCl2+Na2SO4 BaSO4↓+2NaCl (3)若用K2CO3,会引入新杂质KCl.
BaSO4↓+2NaCl (3)若用K2CO3,会引入新杂质KCl.
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




