科学家研制出新的非晶体金属材料,并使其既保持了原本的优点,又具有较强的可延展性.研究者以铜锆合金作为研究对象,这种合金在外力下产生形变后,在特定温度下又会恢复到原来形状.
知能概述
一、金属的化学性质
二、金属活动性顺序
①在金属活动性顺序中,金属的位置越靠前,在水溶液中就越容易失去电子变成离子,它的活动性就越强.根据金属在该顺序中的位置,可判断它的化学活动性.
②在金属活动性顺序中,排在氢前面的金属能置换出酸里的氢,排在氢后面的金属不能置换出酸里的氢,且位置越靠前,反应越剧烈.根据金属在该顺序中的位置,可判断能否与酸发生置换反应产生氢气.
③在金属活动性顺序中,只有排在前面的金属,才能把排在后面的金属从它们的盐溶液里置换出来(K,Ca,Na除外).根据金属单质和盐中金属离子在金属活动性顺序中的位置,可判断金属单质能否跟盐溶液发生置换反应.
三、置换反应
一种单质与一种化合物起反应,生成另一种单质与另一种化合物的反应叫置换反应.金属与非氧化性酸的反应,与某些化合物的溶液反应都是置换反应.
金属活动性的判断方法:能否从化合物的溶液中将其他金属置换出来.
问题解决
例1 在老师的指导下,小乐同学探究金属和盐溶液反应时,发现将钠放入MgCl2溶液中有气泡和白色沉淀产生.为了进一步探究,小乐同学将充分反应后的混合物过滤,得固体A和滤液B.
【查阅资料】
①钠与水反应生成氢氧化钠和氢气.
②MgCl2溶液呈酸性.
【分析与思考】
小乐同学根据所学知识对产生的气体和固体A进行判断;
(1)产生的气体是__________(填序号).
①CO2 ②H2 ③Cl2
(2)取A加入过量稀盐酸,A全部溶解,无气泡产生,则A的化学式是___________.
【提出问题】滤液B中溶质的成分是什么?
猜想一:NaCl
猜想二:NaCl,MgCl2
猜想三:NaCl,NaOH
猜想四:NaCl,MgCl2,NaOH
小乐同学认为猜想___________不成立,理由是_______________________.
【实验探究】
【结论】在金属活动性顺序里,钠不能将位于它后面的金属从该金属的盐溶液中置换出来.
【拓展】将钠与MgCl2固体隔绝空气加热到一定温度时,钠可以从MgCl2中置换出镁,该反应的化学方程式是___________________.
(云南省昆明市中考题)
解题思路 一般地,排在金属活动顺序前的金属可将排在后面的金属从化合物的溶液中置换出来,但K,Ca,Na的化学性质非常活泼,可与水发生剧烈的反应生成氢气和对应的氢氧化物,如将金属钠投入到MgCl2溶液中时:Na➝NaOH➝Mg(OH)2,故有白色沉淀生成,又由于Na与水反应时有H2生成,所以观察到有气泡生成的现象.有关方程式:2Na+2H2O 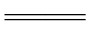 2NaOH+H2↑,MgCl2+2NaOH
2NaOH+H2↑,MgCl2+2NaOH  Mg(OH)2↓+2NaCl.
Mg(OH)2↓+2NaCl.
活泼金属与化合物溶液反应时,不会简单地置换出金属.
例2 颗粒达到纳米级的单质铁具有很强的反应活性,俗称“纳米铁”.实验室制备的方法是:以高纯氮气作保护气,在高温条件下用H2和FeCl2发生置换反应,生成“纳米铁”.请回答以下问题:
(1)写出生成“纳米铁”的化学方程式_______________________________.
(2)反应中需要保护气的原因是__________________________________.
(3)某化学探究小组为了验证铁、铜、镁、汞的金属活动性顺序,设计了如下实验方案:①将镁片加入到硫酸亚铁溶液中;②将铜片加入到硝酸汞溶液中,铜片上出现银白色物质;③将金属片A加入到溶液B中.
根据实验①判断出镁的金属活动性比铁强,依据的现象是____________;根据实验②的现象得出的结论是______________________________________;要通过实验③得出铁和铜的金属活动性顺序,那么,如果B是硫酸铜溶液,则金属A是________,如果A是铜,则溶液B是________.
(湖南省竞赛题)
解题思路 Fe在高温时易与空气中的O2反应,需N2作为保护气,防止生成的“纳米铁”在高温时被氧化,实验①说明活动性Mg>Fe;实验②中Hg被置换,活动性Cu>Hg;实验③中,金属A(Fe片)加入到溶液,有红色物质析出,则活动性Fe>Cu.
例3 某校化学课外活动小组学生利用如图所示装置进行“铁与水反应”的实验,并利用产物进一步与CuO反应(图中夹持及其他后续装置均已略去).已知铁与水在高温下反应产生一种单质气体和一种黑色的金属氧化物,这种金属氧化物与铁在氧气中燃烧的产物是同一物质.碱石灰是一种固体干燥剂,其中含有氢氧化钠和生石灰等物质.
例3图
(1)装置B中发生反应的化学方程式是____________________________.
(2)装置C中右侧导管为什么既不能插入试管底部,又不能只进入试管一点点,其主要原因是_________________________________________________.
(3)实验过程中,最后点燃的是_________(填编号).
①A处酒精灯 ②B处酒精喷灯 ③E处酒精灯
(4)装置E中的现象是__________________________________________.
(湖北省竞赛题)
纳米是长度单位,1纳米=10-9米.
解题思路 B中反应在高温下进行,反应虽有氢气生成,但由于反应物之一是水蒸气,故氢气不能标气体符号;装置C中既有B中产生的氢气,又有未反应完的水蒸气凝结的液体,若C中右侧导管较长,则氢气可将C中的水压入D中.
例4 已知:2Fe(NO3)3+Cu 2Fe(NO3)2+Cu(NO3)2,向硝酸铁和硝酸铜的混合溶液中,加入一定量的铁粉,反应停止后过滤,向滤出的固体加入少量稀盐酸,无气泡产生,则下列说法正确的是( ).
2Fe(NO3)2+Cu(NO3)2,向硝酸铁和硝酸铜的混合溶液中,加入一定量的铁粉,反应停止后过滤,向滤出的固体加入少量稀盐酸,无气泡产生,则下列说法正确的是( ).
A.滤出的固体中不含铁,滤液中含硝酸铁
B.滤液中一定含有硝酸亚铁,不含硝酸铁,可能含有硝酸铜
C.滤液中一定含有硝酸亚铁和硝酸铜
D.滤出的固体中一定含有铜,滤液中可能含有硝酸铁和硝酸铜
(内蒙古自治区呼和浩特市中考题)
解题思路 根据题给信息知:Cu与Fe3+反应生成Cu2+与Fe2+(溶液中),在该溶液中还发生了Fe+Cu(NO3)2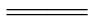 Cu+Fe(NO3)2,反应后的滤液中加入稀盐酸无气泡产生,滤渣中只含铜,有铜剩余时,溶液中无Fe3+即无Fe(NO3)3,一般可从三个方面去分析:有什么?一定没有什么?可能有什么?先分析,再选择.
Cu+Fe(NO3)2,反应后的滤液中加入稀盐酸无气泡产生,滤渣中只含铜,有铜剩余时,溶液中无Fe3+即无Fe(NO3)3,一般可从三个方面去分析:有什么?一定没有什么?可能有什么?先分析,再选择.
例5 把铁粉和氧化铜的混合物加入到一定量的盐酸中,充分反应后,过滤.在滤液中加入少量铁粉,无现象.则下列判断正确的是( ).
A.滤渣中一定不含铜
B.滤液中可能含FeCl2和HCl
C.滤渣可能是铜和铁的混合物
D.滤液中一定含FeCl2和CuCl2
(河南省竞赛题)
解题思路 以上发生了如下反应:
根据题给信息,酸已完全反应,又反应一发生,就有不溶于酸的金属铜析出,所以反应后的滤渣中一定含有铜,利用排除法,正确选项不言而喻.
反应后,无论是滤液或滤渣,讨论其成分时,存在的物质一般为:
(1)未反应的;
(2)反应过量的;
(3)反应生成的.
例6 某同学探究金属化学性质的实验如下图所示.
例6图
(1)上述实验中,有气泡产生的是________(填写装置序号).
(2)F中出现的现象是____________________________________________.
(3)上述实验能否证明镁、锌、铁、铜、银五种金属的活动性顺序?并说明理由_______________________________________________________________.
(4)我国古代“湿法冶铜”就是利用了D中的反应原理,请写出该反应的化学方程式___________________________________________________________.
解题思路 根据金属活动性顺序,Mg,Fe比H活泼,可与酸反应产生H2,D,E中,铁、锌均能置换出铜,F中铜能置换出银,但无法确定Mg,Zn,Fe的活动性顺序.
1.有一种在古籍里称为“鋈”的银白色铜合金,是古代云南、四川地区的特产,其主要成分是铜、锌、镍等金属单质.炼制时需要黑铜矿(主要成分是CuO)、硫化镍矿(主要成分是Ni2S3)等多种矿物.下列有关说法不正确的是( ).
A.鋈属于金属材料
B.鋈的样品在足量稀盐酸中能全部溶解
C.Ni2S3中镍元素呈+3价
D.黑铜矿跟木炭共热能生成单质铜
(2019年浙江省杭州市中考题)
2.(双选)用一张已除去表面氧化膜的铝箔紧紧包裹在试管外壁(如图),将试管浸入硝酸汞溶液中,片刻后取出,然后置于空气中,不久铝箔表面生出“白毛”,红墨水柱右端上升.根据实验现象判断下列说法错误的是( ).
A.铝是一种较活泼的金属
B.实验中发生的反应都是置换反应
C.铝与氧气反应放出大量的热量
D.铝片上生成的白毛是氧化铝和氧化汞的混合物
第2题图
(江西省竞赛题)
铝箔上的“白毛”是置换出的汞与铝形成的合金,俗称“汞齐”.
3.判断金属Zn,Fe,Ag的金属活动性强弱有很多种方法,下列能作为判断依据的是( ).
A.根据金属导电性强弱判断
B.根据金属导热性快慢判断
C.根据锌能把铁从硫酸亚铁溶液中置换出来,铁能把银从硝酸银溶液中置换出来判断
D.根据金属的密度大小判断
(湖南省长沙市中考题)
4.以下是四个化学反应的微观示意图,图中不同的圆圈代表不同的原子.其中能表示置换反应的是( ).
第4题图
(宁夏回族自治区中考题)
5.取一定量打磨后的铝片于某容器中,再逐渐加入稀盐酸.加入稀盐酸的质量与有关量的变化关系图错误的是( ).
第5题图
(2019年广东省中考题)(https://www.xing528.com)
6.某同学欲用实验证明铁、铜、汞、氢的化学活动性顺序,他利用了铁片、铜片、硝酸汞溶液和稀盐酸四种物质,设计了下列实验方案,其中可行的是( ).
A.①Cu+HCl ②Fe+Hg(NO3)2 ③Cu+Hg(NO3)2
B.①Fe+HCl ②Cu+HCl ③Fe+Hg(NO3)2
C.①Fe+HCl ②Fe+Hg(NO3)2 ③Cu+Hg(NO3)2
D.①Fe+HCl ②Cu+HCl ③Cu+Hg(NO3)2
(山东省竞赛题)
7.在Zn(NO3)2,AgNO3及Cu(NO3)2的混合溶液中加入一定质量的铁粉,待充分反应后过滤,下列情况中不可能出现的是( ).
A.滤纸上有Ag;滤液中有Ag+,Cu2+,Zn2+,Fe2+
B.滤纸上有Ag,Cu;滤液中有Zn2+,Fe2+,Cu2+
C.滤纸上有Ag,Fe,Cu;滤液中有Zn2+,Fe2+
D.滤纸上有Ag,Cu,Fe;滤液中有Zn2+,Fe2+,Cu2+
(山西省竞赛题)
金属与非氧化性酸、盐的溶液发生的反应都是置换反应.
Fe的活动性比Cu强,若滤纸上有Fe(Fe过量),则滤液中一定不会有Cu2+存在.
8.某样品除含有铁粉外还可能混有C粉、CuO粉末中的一种或两种,将该粉末加入到一定量的稀硫酸中,充分反应后过滤,向滤液中加入锌粉,锌粉的表面有气泡产生,将滤渣在氧气中充分灼烧,产生能使澄清石灰水变浑浊的气体并有固体残留.下列说法正确的是( ).
①样品中一定含有C粉和CuO粉末
②样品中一定含有CuO粉末,可能含有C粉
③残留固体的质量等于样品中CuO的质量
④滤液中一定含有FeSO4,H2SO4,可能含有CuSO4
⑤滤渣中一定含有C粉和Cu
A.①②③ B.①④⑤ C.②③④ D.②③⑤
(江苏省竞赛题)
9.(双选)在a,b两支试管中加入体积相同的同种生铁块.在a中加入食盐水,塞上橡皮塞,如右图.U形玻璃管内为红墨水(开始时两端液面等高).放置一段时间后,下列有关叙述错误的是( ).
A.生铁块中的主要成分是铁,也含有少量的碳
B.红墨水柱两边的液面变为左低右高
C.两试管中铁均被锈蚀
D.a试管中主要发生的反应是:2C+2Fe+3O2 2FeCO3
2FeCO3
第9题图
(全国复赛题)
10.印刷电路板常用氯化铁溶液作为“腐蚀液”,发生的反应为2FeCl3+Cu 2FeCl2+CuCl2,向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,剩余固体的成分不可能是( ).
2FeCl2+CuCl2,向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,剩余固体的成分不可能是( ).
A.有铁无铜 B.有铜无铁
C.铁、铜都有 D.铁、铜都无
(2019年湖南省常德市中考题)
11.成功着陆月球背面的“嫦娥四号”探测器使用了多种材料.
(1)探测器上的五星红旗含有一种叫聚酰亚胺的有机高分子材料.该材料属于_________(填“金属”或“合成”)材料.
(2)探测器使用的铝合金硬度比纯铝的硬度_________(填“大”或“小”).
(3)探测器广泛使用了Al,Fe,Cu.利用它们完成如下实验:
①将未打磨的铝片放入FeSO4溶液中,没有明显现象
②将打磨过的铝片放入FeSO4溶液中,铝片表面有明显变化
③将打磨过的铁片放入CuSO4溶液中,铁片表面变红
实验①中无现象是因为铝片表面有一层致密的_________(填化学式)薄膜.
实验②中发生反应的化学方程式为_____________________________.
实验③中铁片足量,充分反应后溶液变为_________色.
(2019年重庆市中考题)
铁锈的成分是Fe2O3·xH2O.
在食盐水中铁锈蚀得更快.
溶液还有以下反应发生:Fe+CuCl2 FeCl2+Cu
FeCl2+Cu
12.人类文明进步与金属材料发展关系十分密切.某课外兴趣小组探究金属的性质.
(1)用等质量相同表面积的镁条,等体积不同浓度的稀盐酸,在一定条件下反应,实验结果如图所示:
第12题图
对比a,b曲线,引起a曲线压强迅速增大的因素可能有__________________________,_________________________.
(2)将1g含镁48%的镁铝合金(不含其他元素)粉末在氧气中加热,至反应完全.
①该合金中镁消耗氧气的质量最多是________.
②该合金与氧气反应后生成固体的质量最多是_________(计算结果保留一位小数).
(2019年江苏省南京市中考题)
13.化学课代表小聪与小明同学帮助实验老师整理化学药品室时,发现分别放在两个试剂瓶中的两片用砂纸磨得光亮的银白色金属,未贴标签.到底它们是哪种金属?两位同学首先对这两种金属X和Y的金属活动性顺序进行实验探究.
(1)进行猜想:
①小聪猜想:活动性X大于Y.
②小明同学猜想:活动性Y大于X.
(2)设计实验方案、进行实验、获得知识.完成如下实验报告,并回答后续有关问题.
(3)上述实验之前,实验老师只知道X,Y是银、铁中的各一种,则根据实验结果说明Y就是_________.实验室急需一定量的Y粉末,小聪认为可用现有的X金属粉末和Y的盐溶液、蒸馏水等药品,配以必要的仪器来制得急需的Y粉末,原因是(用反应的化学方程式表示)______________________________________________________.
(4)实验老师经实验分析得知制得的Y粉末中含有未反应完的X粉末,若用化学方法将杂质X粉末除去,两个同学经讨论、交流一致认为可选用的除杂质试剂是_________.
(广东省竞赛题)
14.中国古代文献记载了丰富的化学知识.
(1)我国是最早生产钢铁的国家之一.“百炼成钢”是指将生铁转化为钢,其主要原理是降低生铁中___________(填符号)元素的含量.
(2)黑火药是我国的“四大发明”之一,爆炸时发生的主要反应如下,请完
成配平(在方框内配上计量数,计量数“1”也要写):![]()
![]()
(3)我国是最早采用湿法冶铜的国家.文献记载“胆铜法”:用铁与“胆水”(含CuSO4)反应获得铜.写出反应的化学方程式:_______________.
(4)古诗“投泥泼水愈光明”:在高温条件下,炭与水蒸气反应得到两种可燃性气体.写出反应的化学方程式:_________________________.
(福建省厦门市中考题)
15.已知钠与水反应的化学方程式为:2Na+2H2O  2NaOH+H2↑.质量均为mg的钠、镁、锌三种金属分别与25g质量分数为19.6%的稀硫酸反应.
2NaOH+H2↑.质量均为mg的钠、镁、锌三种金属分别与25g质量分数为19.6%的稀硫酸反应.
(1)由于金属的量不确定,产生的氢气的质量大小有多种可能(不考虑镁与水的反应),如镁、锌产生氢气的质量相同且都小于钠产生的氢气质量表示为Na>Mg=Zn.请按以上表示,写出所有可能情况.
___________________________________________________
(2)试确定,当产生的氢气的质量大小为Na>Mg=Zn时,m的取值范围为________.
(3)m=4.6时,Zn与酸反应产生H2的质量与金属质量(m)的关系如下图.请在图中再画出钠和镁两种金属分别与酸反应产生H2的质量与金属质量(m)的关系图线.(在图线上用元素符号注明)
第15题图
(全国复赛题)
注意:①化学方程式凡以填空形式呈现时,化学计量数为1时也应填上.
②高温时,水为蒸气,故反应后生成的气体不应标“↑”.
例1 【分析与思考】(1)② (2)Mg(OH)2 【提出问题】四 MgCl2和NaOH会发生化学反应.
【实验探究】
【拓展】2Na+MgCl2 Mg+2NaCl
Mg+2NaCl
例2 (1)![]()
(2)防止铁在高温下与氧气反应
(3)镁片上有物质析出,溶液逐渐由浅绿色变为无色 铜比汞的金属活动性强 铁 盐酸等
例3 (1)![]() (2)因为B中反应有氢气生成,而A中产生的水蒸气在B中不可能完全反应,将凝结成水聚集在试管底部 (3)③ (4)黑色固体变红(右端管壁有水珠)
(2)因为B中反应有氢气生成,而A中产生的水蒸气在B中不可能完全反应,将凝结成水聚集在试管底部 (3)③ (4)黑色固体变红(右端管壁有水珠)
例4 B 例5 C
例6 (1)AC (2)铜片表面覆盖一层银白色物质 (3)不能;无法比较Mg,Fe,Zn之间的活动性顺序 (4)![]()
1.B 2.BD 3.C 4.B 5.B 6.D 7.D 8.B 9.BD 10.A
11.(1)合成 (2)大 (3)Al2O3 2Al+3FeSO4 3Fe+Al2(SO4)3 浅绿
3Fe+Al2(SO4)3 浅绿
12.(1)温度 盐酸的浓度(溶质的质量分数) (2)①0.32g ②1.8g
13.(2)①将金属片X,Y分别放入两支试管中,再分别加入稀硫酸(或稀盐酸)2mL
③在金属活动顺序里,X排在氢前,Y排在氢后(或金属的活动性为X大于Y) 正确
(3)银![]()
(4)盐酸(或稀硫酸)
15.(1)Na>Mg>Zn,Na=Mg>Zn,Mg>Na>Zn
(2)m≥3.25
(3)
第15题答图
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




