元素:我们把原子序数相同的一类原子称作元素,每一种原子对应一种化学元素。例如氢原子对应氢元素,氧原子对应氧元素。目前,包括人工制造的,人们已经发现了一百多种元素。原子的化学性质仅仅取决于核外电子数目,也就是仅仅取决于它的原子序数。例如,1H、2H、3H都是氢元素,它们的质子数相同中子数不同;60Co和57Co都是钴元素,他们的质子数相同中子数不同。
核素:是指在其核内具有一定的中子和质子以及特定能态的一种原子核或原子。例如,1H、2H、3H是三种独立的核素,因为它们的原子核内中子数不同;60Co和57Co是两种独立的核素,虽然它们的原子核内含有相同的质子数和中子数,但它们的原子核所处的能态是不同的。
同位素:一种元素所有原子都有相等数目的质子,但其中子数不尽相同,也就是说,一种元素可以有多种类型的原子。例如元素氢(H)的原子序数为1,原子核中只有一个质子,但氢原子核有三种不同的类型,如表1.1所示。
表1.1 氢元素的三种类型(https://www.xing528.com)
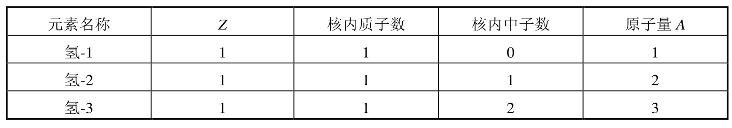
又如:原子序数Z=53的元素碘(I),有20种不同的原子,原子核内中子数最少的为67,最多的为86。这些质子数相同、中子数不同、属于同一元素的原子,具有相同的化学性质,在化学元素周期表上排在同一位置,称之为同位素。
同质异能素:寿命较长的激发态原子核称为基态原子核的同质异能素或同核异能素。它们的A和Z均相同,只是能量状态不同。一般在元素符号的左上角质量数A后加上字母m表示,这种核素的原子核一般处于较高能态,例如![]() 称为
称为![]() 的同质异能素,其半衰期为2.81 h。同质异能素所处的能态,又称为同质异能态。它与一般的激发态在本质上并无区别,只是半衰期即寿命较长而已。
的同质异能素,其半衰期为2.81 h。同质异能素所处的能态,又称为同质异能态。它与一般的激发态在本质上并无区别,只是半衰期即寿命较长而已。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




