【课标要点】
1.了解饱和溶液和溶解度的含义。
2.利用溶解性表或溶解度曲线,查阅有关物质的溶解性或溶解度,依据给定的数据绘制溶解度曲线。
3.利用溶解度的简单计算。
【梳理归纳】
1.固体物质的溶解度
在一定温度下,该物质在100g溶剂(通常溶剂为水)里达到饱和状态时所溶解溶质的克数。
2.饱和溶液与不饱和溶液
在一定温度下,一定量的溶剂里不能再溶解某种溶质的溶液,叫这种溶质的饱和溶液,还能继续溶解某种溶质的溶液,叫这种溶质的不饱和溶液。
3.饱和溶液溶质质量分数与溶解度的关系
一定温度下,某物质饱和溶液溶质质量分数(w)与该温度下该物质的溶解度(S)的数学关系式为
4.固体物质的溶解度与温度的关系
大多数固体物质的溶解度随温度升高而增大(如KNO3);少数固体物质的溶解度受温度变化影响不大(如NaCl);极少数固体物质的溶解度随温度的升高而减少[如Ca(OH)2]。
*5.气体的溶解度与温度和压强的关系
气体的溶解度随温度升高而减小,随压强增大而增大。
【案例分析】
1.根据溶解度曲线进行判断
例1 t1℃时,将等质量的硝酸钾和氯化钾分别加入到各盛有100g水的两个烧杯中,充分搅拌后现象如图(a)所示,硝酸钾和氯化钾的溶解度曲线如图(b)所示。
(1)烧杯②中的上层清液是否达到饱和状态?________(填“是”“否”或“无法判断”)。
(2)烧杯①中溶解的溶质是________(写名称或化学式)。
(3)将t1℃时50g硝酸钾的饱和溶液稀释成10%的溶液,需加水________g。
(4)关于图(a)中烧杯内的物质,下列说法正确的是( )。
A.烧杯①内溶液中溶质的质量分数大于烧杯②内上层清液中溶质的质量分数
B.蒸发一定量的水,两烧杯中都一定有固体析出
C.将两个烧杯中的溶液混合,充分搅拌后,烧杯中一定还有剩余固体
D.将温度升高到t2℃,两烧杯内溶液中溶质的质量分数相等(不考虑水的蒸发)
分析 本题考查固体的溶解度曲线所表示的意义,以及根据固体的溶解度曲线来解决相关的问题。(1)烧杯②中有固体剩余,所以上层的清液达到饱和状态。(2)t1℃时,氯化钾的溶解度大于硝酸钾的溶解度,所以烧杯①中溶解的溶质是氯化钾。(3)t1℃时硝酸钾的溶解度是25g,所以饱和溶液的溶质质量分数为![]() ,所以将t1℃时50g硝酸钾的饱和溶液稀释成10%的溶液,需加水
,所以将t1℃时50g硝酸钾的饱和溶液稀释成10%的溶液,需加水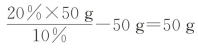 。(4)等质量的固体溶解在100g水中,烧杯①中没有固体剩余,烧杯②中有固体剩余,所以烧杯①内溶液中溶质的质量分数大于烧杯②内上层清液中溶质的质量分数,故A正确;烧杯①中溶液是否饱和不能确定,所以蒸发一定量的水,烧杯①中不一定有固体析出,故B错误;将两个烧杯中的溶液混合,充分搅拌后,烧杯中不一定还有剩余固体,故C错误;将温度升高到t2℃,此时硝酸钾与氯化钾的溶解度相等,烧杯①能将氯化钾全部溶解,则烧杯②也能将硝酸钾全部溶解,所以两烧杯内溶液中溶质的质量分数相等,故D正确。
。(4)等质量的固体溶解在100g水中,烧杯①中没有固体剩余,烧杯②中有固体剩余,所以烧杯①内溶液中溶质的质量分数大于烧杯②内上层清液中溶质的质量分数,故A正确;烧杯①中溶液是否饱和不能确定,所以蒸发一定量的水,烧杯①中不一定有固体析出,故B错误;将两个烧杯中的溶液混合,充分搅拌后,烧杯中不一定还有剩余固体,故C错误;将温度升高到t2℃,此时硝酸钾与氯化钾的溶解度相等,烧杯①能将氯化钾全部溶解,则烧杯②也能将硝酸钾全部溶解,所以两烧杯内溶液中溶质的质量分数相等,故D正确。
2.有关饱和溶液中溶解度和溶质的质量分数之间的换算
例2 已知20℃时,氯化钠的溶解度为36g。在此温度下,20g水中最多溶解氯化钠的质量为多少克?
分析 根据公式![]() 即可求出。
即可求出。
解 设20g水中最多溶解氯化钠的质量为x。
答:20g水中最多溶解氯化钠的质量为7.2g。
例3 氯化钠在20℃时溶解度为36g,在20℃时,将30g氯化钠加到70g水中,所得氯化钠溶液的溶质质量分数为多少?
分析 首先要通过计算得出在20℃时,70g水中最多溶解的氯化钠的质量,从而判断加入30g NaCl后形成的是饱和溶液还是不饱和溶液。若为饱和溶液,可根据溶解度求出其质量分数;若为不饱和溶液,可根据30g溶质、70g水求出结果。
解 设20℃时,70g水中最多溶解的氯化钠的质量为x。
x=25.2g<30g,即加入30g氯化钠后得到的氯化钠溶液为饱和溶液。
因此可根据溶解度直接求出溶液的溶质质量分数,或根据70g水中最多溶解25.2g氯化钠求出溶液的溶质质量分数。
答:所得氯化钠溶液的质量分数为26.5%。
3.改变溶剂量或改变温度对溶液的影响
例4 20℃时,200g氯化钠饱和溶液蒸发掉50g水,析出NaCl晶体多少克?(20℃时,NaCl晶体的溶解度为36g)
解 设析出NaCl的质量为x。
答:析出NaCl晶体18g。
【基础检测】
(一)选择题(单项选择)
1.现有一杯20℃的KNO3饱和溶液200g,今欲改变该饱和溶液中KNO3的溶质质量分数,可采取的措施有( )。
A.保持温度不变,蒸发掉20g水 B.保持温度不变,加入20g KNO3
C.保持温度不变,取出20g溶液 D.保持温度不变,加入20g NaCl
2.下列关于溶液的叙述正确的是( )。
A.任何溶液中只可能含有一种溶质(https://www.xing528.com)
B.饱和溶液一定是浓溶液,不饱和溶液一定是稀溶液
C.将某溶液降温后,其溶液的溶质质量分数可能不变
D.一定温度下,物质的溶解度随水的量的变化而变化
3.欲使某气体的溶解度增大,可采用方法是( )。
A.升高温度、减小压强
B.升高温度、增大压强
C.降低温度、增大压强
D.降低温度、减小压强
4.如图为三种物质的溶解度曲线。下列说法错误的是( )。
A.约在64℃时,KCl和Na2SO4的溶解度相等
B.在室温至100℃区间,随温度升高Na2SO4的溶解度先增大后减小,醋酸钙则相反
C.分离含少量KCl的Na2SO4溶液,采用先蒸发浓缩,再降温结晶的方法
D.在40℃时,40g KCl固体溶于60g水得到40%KCl溶液
5.右图为氯化铵和硫酸钠的溶解度曲线。下列说法中错误的是( )。
A.30℃时,氯化铵、硫酸钠的溶解度相等
B.将60℃的硫酸钠饱和溶液降温至40℃,有晶体析出
C.氯化铵的溶解度随温度的升高而增大
D.在30~70℃范围内,硫酸钠饱和溶液在40℃时,溶质质量分数最大
(二)填空题
6.在20℃时,取NaCl和Ca(OH)2各10g,分别与90g水充分混合,所得溶液的质量分数为10%的是__________溶液。
7.我国海洋资源十分丰富。随着科学技术的不断发展,不仅可以通过高分子材料来淡化海水,还可以从海水中提取食盐、金属镁等重要的化学物质。
(1)海水晒盐所获得的粗盐中含有难溶性杂质和MgCl2、CaCl2、KCl等可溶性杂质。在实验过程中粗盐经过溶解、________、________可得到初步提纯。
(2)如图是MgCl2、KCl和MgSO4三种物质的溶解度曲线示意图。设t1℃时,MgCl2、KCl和MgSO4三种物质的溶解度分别为a、b、c,则它们的大小关系为___________。t2℃时,MgCl2、KCl两种物质的饱和溶液中溶质质量分数较大的是_______________。
8.下列数据是硝酸钾固体在不同温度时的溶解度。
(1)20℃时,向100g水中加入31.6g硝酸钾,充分溶解后得到___________(填“饱和”或“不饱和”)溶液。
(2)20℃时,向100g水中加入40g硝酸钾,若使硝酸钾完全溶解,可以采用的方法是____________________。
(3)如图所示,小烧杯中盛放的是上述(1)中所得硝酸钾溶液,若将少量的下列物质分别放入大烧杯中的水中,不断搅拌,则小烧杯中一定有硝酸钾晶体析出的是________(填序号)。
A.冰 B.氢氧化钠 C.硝酸铵 D.干冰 E.生石灰
(4)通过________操作可将上述(3)中析出硝酸钾晶体与硝酸钾溶液分离。
9.在20℃时,A物质在水里的溶解度为15g,B物质饱和溶液的溶质质量分数为15%。则20℃时,A的溶解度__________(填“大于”“等于”或“小于”)B的溶解度。
(三)计算题
10.在30℃时,重铬酸钾的饱和溶液500g蒸发掉40g水,求析出重铬酸钾多少克?(30℃时重铬酸钾的溶解度为20g)
11.在一定温度下,往质量都是50g的五份水中分别加入30g、40g、50g、60g、70g KNO3,充分搅拌后,滤去未溶解的KNO3,加入KNO3的质量与相应所得溶液的质量的五组数据如下表。求该温度下KNO3的溶解度。
【探究尝试】
下表列出了KNO3与NaCl在不同温度时的溶解度:
(1)现有含123gKNO3与17.9gNaCl的混合物,某同学设计了以下实验除去KNO3中的NaCl(操作过程中不考虑额外的水损失)。
①向混合物中加入适量水,加热溶解;
②继续加热溶液至100℃并恒温蒸发浓缩;
③将溶液降温至10℃,仅得到KNO3晶体,过滤,将所得KNO3晶体洗涤并干燥。
A.步骤②中,为确保没有晶体析出,溶液中至少要保留__________g水;
B.步骤③中,最多可得到KNO3晶体__________g;
C.根据上述实验可概括出除去KNO3中少量NaCl的主要步骤:
加热溶解→蒸发浓缩→__________→过滤→洗涤→干燥;
D.洗涤时,应选用少量______(填“热水”或“冷水”),其目的是_____________________。
(2)除去NaCl中少量KNO3的一种方法是:将NaCl和KNO3的混合物置于适量水中,加热,搅拌,待KNO3全部溶解,趁热过滤,将过滤所得的NaCl晶体进行洗涤和干燥。上述方法中,趁热过滤的目的是:_________________________________________________。
(3)取23.4gNaCl和40.4gKNO3,加70g水,加热溶解。在100℃时蒸发掉50g水,维持该温度过滤,得到的晶体质量为__________g;将滤液冷却至10℃,充分结晶,写出析出的晶体的化学式:______________。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




