【课标要点】
1.认识物质的微粒性,知道分子、原子、离子等都是构成物质的微粒。
2.能用微粒的观点解释某些常见的现象。
3.知道原子是由原子核和核外电子构成的。
4.知道原子可以结合成分子,同一元素的原子和离子可以互相转化。初步认识核外电子在化学反应中的作用。
【梳理归纳】
1.物质与其构成微粒之间的关系
2.建立“物质由微粒组成和微粒运动”的观点
(1)所有物质一般都是由肉眼看不见的极微小的粒子所构成。
(2)构成物质的微粒有分子、原子、离子,分子又由原子构成(但稀有气体分子就是原子)。
(3)离子是带电荷的原子或原子团。
(4)原子、分子处于永恒的运动中,温度愈高,微粒的运动速率愈大。
(5)微粒之间有间隔,一般而言温度愈高,微粒之间的间隔愈大。
(6)微粒之间有作用力。
(7)自由移动离子的存在是溶液导电的关键,自由移动电子的存在是金属导电的关键。
3.分子
(1)分子是构成物质的一种微粒。氢气、氧气、水、二氧化碳等物质都是由分子构成的。
(2)同种物质的分子性质相同,不同种物质的分子性质不相同。
4.原子
(1)原子是构成物质的一种基本微粒。金刚石和稀有气体(如氦、氖)等都是由原子直接构成的;常见的金属(如铁、铜、铝、汞等)是由自由电子、金属离子和金属原子构成的。
(2)原子是由带正电荷的原子核和带负电荷的核外电子构成的;两者所带的电荷量大小相等,电性相反,因而原子呈电中性。
(3)原子核的半径大约是原子半径的十万分之一。原子核的体积虽然很小,但原子核几乎集中了原子的全部质量。
(4)核外电子在原子核外空间高速运动。在含有多个电子的原子里,核外电子在不同的电子层内运动的。可用原子结构示意图表示如下:
5.离子
(1)离子也是构成物质的一种基本微粒。氯化钠、氯化铵、硫酸钾、硝酸钙等化合物是由阴、阳离子所构成的。
(2)离子与原子通过电子得失可以相互转化。
(3)离子结构示意图:
在阳离子中,质子数>核外电子总数,如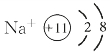 。
。
在阴离子中,质子数<核外电子总数,如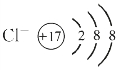 。
。
(4)同种元素的原子与离子由于其结构(最外层电子数不同)不同,所以它们的性质也不同。
(5)常见离子:
阳离子:H+、Na+、Mg2+、Al3+、K+、Ca2+、Zn2+、Ba2+、Fe2+、Fe3+、Ag+等。
阴离子:![]() 等。
等。
6.元素、分子、原子、离子的区别与联系
(1)元素与原子的比较:
(2)分子与原子的比较:
(3)原子与离子的比较:
(4)元素与原子最外层电子数的关系:
【案例解析】
例1 用正确的微粒名称或元素名称填写:
构成水的微粒是__________;水受热变成水蒸气时__________没有改变,构成水分子的微粒是__________和__________;电解时__________和__________没有改变,构成生成物的微粒是__________和__________。
分析 水受热变成水蒸气属于物理变化,水分子本身没有发生改变,只是水分子之间的间隔和运动速率发生变化;而水电解发生的是化学变化,水分子分裂,氢、氧原子再重新组合成新物质的分子,即氢气分子和氧气分子,在此过程中氢、氧元素没有变成其他的元素。
答案 水分子;水分子;氢原子;氧原子;氢元素;氧元素;氢气分子;氧气分子
例2 证明分子在化学反应中可分的是( )。
A.铁矿石磨成粉末 B.加热氧化汞有银白色汞生成
C.碘固体受热形成紫色蒸气 D.汽油挥发
分析 物质在发生化学变化时,分子先分成原子,原子再组成新的分子或直接聚集成物质,所以解本题的关键,是认清在变化前后分子要发生变化。换句话说,如果是物理变化,分子在变化前后不发生变化,就无法证明分子在化学反应中可分。
选项A中,铁矿石虽然由块状磨成了粉末,但构成铁矿石的分子并没有改变。
选项B中,加热氧化汞后,有新的物质银白色的汞生成,肯定属于化学变化,反应前是氧化汞分子,氧化汞分子先分成氧原子和汞原子,每两个氧原子结合成一个新的氧分子,许多氧分子构成氧气。许多汞原子直接构成银白色的汞,从而证明在化学反应中分子可分。
选项C中,碘固体受热生成了紫色蒸气是由于碘分子受热后运动速度加快,使分子间的间隔变大而变成了气体,碘分子本身没有改变,它只是物质状态改变了。
选项D中,汽油挥发的理由和选项C相同,汽油分子没有改变。
答案 B
例3 装开水的保温瓶盖有时会跳出来,为什么?
分析 保温瓶内进入了空气,盖上瓶盖后,空气受热膨胀,微粒间隙增大,瓶内压强增大,就会使瓶盖跳出来。
答案 保温瓶盖有时会跳起来的原因之一是,瓶内开水没装满,瓶里留有空气,受热后微粒空隙增大,或者倒开水时,冷空气进入瓶内,盖上瓶盖,空气受热,气体微粒间空隙增大,体积膨胀,瓶内压强增大使瓶盖跳出来。
【基础检测】
(一)选择题(单项选择)
1.下列化学用语既能表示一种元素,又能表示一个原子,还能表示一种物质的是( )。
A.H B.Fe C.N2 D.H2O
2.液氨汽化过程中,发生改变的是( )。
A.氨气分子的大小 B.氨气分子的组成
C.氨气分子间的距离 D.氨气的化学性质
3.夏夜,我们在公园或在校园的小道上散步时,每走到茉莉花的附近就能闻到花香,说明( )。
A.分子的体积和质量都很小 B.分子间有一定的间隔
C.分子在不断地运动 D.分子可以再分
4.碳-14是一种质子数为6,相对原子质量为14的原子,它可以蜕变成碳-12。在考古学中常用碳-14蜕变的量来精确地测定出土文物的年代。碳-12是一种质子数为6,相对原子质量为12的原子,则碳-14和碳-12属于( )。
A.同种元素 B.同种原子 C.同种分子 D.同种单质
5.下列物质中含氧分子的是( )。
A.高锰酸钾 B.过氧化氢 C.水 D.空气
6.下列微粒符号中,对“2”含义的理解正确的是( )。
A.2Cu中的“2”表示2个铜元素(https://www.xing528.com)
B.Fe2+中的“2”表示每个亚铁离子带有2个单位的正电荷
C.H2S中的“2”表示一个硫化氢分子中含有两个硫原子
D.![]() 中化学式上方的“2”表示硫元素为-2价
中化学式上方的“2”表示硫元素为-2价
7.我国著名化学家徐光宪因在稀土元素等研究领域做出杰出贡献,荣获2008年度“国家最高科学技术奖”。铈(Ce)是一种常见的稀土元素,下列关于铈的说法错误的是( )。
A.原子序数是58 B.相对原子质量是140.1
C.质子数为58 D.铈元素是非金属元素
8.下列物质由阴、阳离子构成的是( )。
A.干冰 B.黄金 C.金刚石 D.氯化钾
9.某微粒核外有10个电子,核内有9个质子,则该微粒是( )。
A.分子 B.原子 C.阴离子 D.阳离子
10.下列叙述错误的是( )。
A.分子、原子和离子都能直接构成物质
B.原子中原子核与核外电子的电量相等,电性相反,所以整个原子不显电性
C.决定原子质量大小的主要是质子和电子
D.原子如果得到或失去电子就变成离子
11.下列现象中不宜仅用微粒运动的观点解释的是( )。
A.把两块表面干净的铅压紧,就不容易将它们拉开
B.在室内,同样表面积的热水比冷水蒸发得快
C.水通电分解生成氢气和氧气
D.医院里充满了酒精味和药味
12.一种元素的原子变成离子发生的变化是( )。
A.一定得到电子 B.一定失去电子
C.可能得到电子,也可能失去电子 D.不得到电子,也不失去电子
13.对下列实验现象进行的解释错误的是( )。
14.分子是构成物质的一种粒子。下列有关水分子的叙述正确的是( )。
A.受热时水分子的体积逐渐变大
B.降温时水分子的化学性质发生改变
C.反应时构成水分子的原子种类发生改变
D.电解水生成氢气和氧气说明水分子是可分的
15.下列物质中,由原子构成的是( )。
A.氯化氢气体 B.氯化钠 C.水蒸气 D.金刚石
(二)填空题
16.某隐形眼镜洗液的主要成分是双氧水(H2O2)。
(1)双氧水是由__________元素组成的。
(2)一个双氧水分子是由_______________原子组成。
17.某组同学进行某一问题的探究,探究的内容是:化学反应中分子是否发生了变化?元素是否发生了变化?化学反应案例:
(1)反应物的分子是__________,生成物中的分子是__________和__________。由此说明化学反应中分子种类__________(填“发生”或“不发生”)改变。
(2)反应物中出现的元素有__________,生成物中出现的元素有__________。由此说明化学反应中元素种类__________(填“发生”或“不发生”)改变。
18.用适当的化学符号填空:
①三个硅原子__________;②保持二氧化碳化学性质的微粒__________;
③两个硝酸根离子__________;④标出碳酸中碳元素的化合价__________;
⑤氖气__________;⑥三个氯分子__________;
⑦氯化亚铁__________;⑧氢氧化铝__________;
⑨碳酸钡__________;⑩硫酸铵__________。
19.我们的生活与化学密切相关,请你用化学式填写下列空白:
(1)大气中能产生“温室效应”的甲烷气体_____________________;
(2)新型纳米材料氧化铝_____________________;
(3)能改良土壤酸性的熟石灰_____________________;
(4)用作化肥的碳酸氢铵_____________________。
(三)简答题
20.下面是碳的几种单质的结构示意图,图中小圆圈均代表碳原子。
(1)在物质甲的结构中,每个碳原子最多连有__________个碳原子。
(2)根据乙物质层与层之间能发生滑动,具有滑腻感的特点,写出它的一种用途____________________。
(3)图中物质丙的化学式为C60,已知硅的一种单质也有与物质丙相同的原子数和类似的结构,有科学家尝试把物质丙的一个分子放进硅的这种单质的一个分子中,反应形成一种新型分子,该分子的化学式为_____________________。
21.下表为元素周期表中某一周期元素的原子结构示意图。
请回答下列问题:
(1)表中磷原子的核电荷数x=__________。
(2)表中具有相对稳定结构的元素是__________。
(3)在化学反应中,每个铝原子失去__________个电子形成铝离子。
(4)镁元素与氯元素形成的化合物化学式为_____________________。
(5)上述元素在周期表中处于同一周期的原因是 。
(6)硫与氧气的反应![]() 可用右图表示:设N个氧气分子的质量为32g,则64g氧气与足量硫粉完全反应生成的二氧化硫分子数为__________。
可用右图表示:设N个氧气分子的质量为32g,则64g氧气与足量硫粉完全反应生成的二氧化硫分子数为__________。
a.浓氨水;b.固体氢氧化钠;
c.湿润的酚酞滤纸条
【探究尝试】
某同学在学完《分子和原子》后,进行了如右图所示实验:
请回答下列问题。
(1)在小试管中加入2~3片氢氧化钠固体的作用是___________________________________________。
(2)滴入2~3滴浓氨水后,在c处可观察到的现象是___________________________________________。
(3)此装置除操作简单、现象明显、药品用量少、省时等优点外,还有一个显著的优点是___________________________________________________________________________________________。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




