实验室制取氯化氢气体一般是用固体氯化钠和浓硫酸反应,不加热或稍微加热,分别生成硫酸氢钠和氯化氢。
为什么一定要用浓硫酸和固体氯化钠反应?为什么不可以用稀硫酸和食盐溶液?
* * *
实验室制取CO2气体,用CaCO3和稀盐酸反应。初中化学中解释是“有气体生成”或“强酸制弱酸”;高中化学中用勒夏特列平衡移动原理解释为CO2是气体,逸出后会导致产物浓度下降,平衡向离子浓度降低的方向移动。所以,反应得以发生,若套用“强酸制弱酸”的原理,在学习![]() 反应时,又产生矛盾。只能解释为Cu2+和S2-结合生成难溶于硫酸的沉淀,导致离子浓度下降,平衡向离子浓度下降方向移动。
反应时,又产生矛盾。只能解释为Cu2+和S2-结合生成难溶于硫酸的沉淀,导致离子浓度下降,平衡向离子浓度下降方向移动。
按照复分解反应发生的条件,生成沉淀、气体等都属于离子浓度下降。下面通过计算阐述用食盐水得不到氯化氢气体的理由。(https://www.xing528.com)
氯化氢气体极易溶于水,20℃时1体积水能溶解400体积的氯化氢。若用食盐水和稀硫酸反应,可以推导得:20℃时,食盐在水中的溶解度为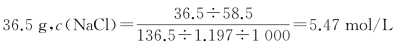 (饱和食盐水密度为1.197 g/m L)。
(饱和食盐水密度为1.197 g/m L)。
20℃时,氯化氢在100 g水(即100 mL水)中溶解约40 L,1 mol气体的体积约24 L,此时盐酸的质量分数为37.8%,密度为1.19 g/mL。
饱和食盐水中的c(Cl-)对盐酸来说,还未达到饱和,就会使制得的HCl不断溶于食盐水中,而得不到氯化氢气体。
从化学平衡移动角度分析,增加反应物的浓度有利于反应向正反应方向移动。使用固体食盐,反应中c(Cl-)“浓度”始终不会减少。如果用食盐水,c(Cl-)会不断减少,生成物也会减少。因为浓硫酸是高沸点酸,沸点为338℃,具有难挥发性,氯化钠为离子化合物,沸点很高,所以认为这个反应的原理为“高沸点酸制低沸点酸”。但是,不能用浓硫酸制取H 2S、HI等气体。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




