肌原纤维是骨骼肌的收缩单位,由细丝状的蛋白质凝胶组成。这些细丝平行排列成束,直接参与收缩过程。肌原纤维蛋白质的含量随肌肉活动而增加,并因静止或萎缩而减少。而且肌原纤维中的物质与肉的某些重要品质特性(如嫩度)密切相关。肌原纤维蛋白质占肌肉蛋白质总量的40%~60%,它主要包括肌球蛋白、肌动蛋白、肌动球蛋白和2~3种调节性结构蛋白质等,如表1-5所示。
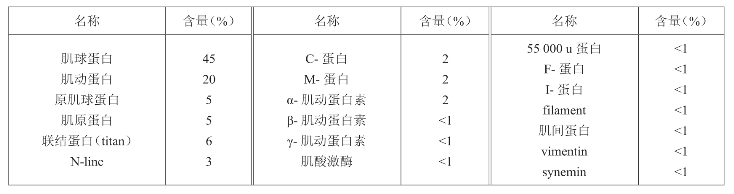
表1-5 肌原纤维蛋白质的种类和含量
1.肌球蛋白
肌球蛋白在离子强度0.2以上的盐溶液中溶解,在0.2以下呈不稳定的悬浮状态,等电点为pH5.4,具有流动双折射现象;具有ATP酶的活性,Mg2+对此酶起抑制作用,Ca2+可以将其激活。肌球蛋白的另一个特征是能与肌动蛋白结合,生成肌动球蛋白。肌动球蛋白是关系到肉在加工中的嫩度变化和某些其他性质的重要成分。肌球蛋白对热很不稳定,受热发生变性。变性的肌球蛋白失去了ATP酶的活性,溶解性降低。肌球蛋白是构成粗丝的主要蛋白质,粗丝由350~400个肌球蛋白组成,尾部重叠,头部伸向外头。由两条很长的肽链相互盘旋构成,两条肽链各形成一盘旋的头部。在尾部有数条轻链。肌球蛋白的形状很像“豆芽”,全长为140 nm,其中头部20 nm,尾部120 nm;头部的直径为5 nm,尾部直径2 mm。
2.肌动蛋白
肌动蛋白约占肌原纤维蛋白的20%,肌动蛋白以球状肌动蛋白(G-肌动蛋白)和纤维状的肌动蛋白(F-肌动蛋白)的形式存在,是构成细丝的主要成分,肌动蛋白对热较肌球蛋白稳定。肌动蛋白只有一条多肽链构成,其分子量为41 800~61 000。肌动蛋白单独存在时,为一球形的蛋白质分子结构,称G-肌动蛋白,当G-肌动蛋白在有磷酸盐和少量ATP存在的时候,即可形成相互连接的纤维状结构,需300~400个G-肌动蛋白形成一个纤维状结构;两条纤维状结构的肌动蛋白相互扭合成的聚合物称为F-肌动蛋白。肌动蛋白的性质属于白蛋白类,它还能溶于水及稀的盐溶液中,在半饱和的(NH4)2SO4溶液中可盐析沉淀,等电点为pH4.7。F-肌动蛋白在有KI和ATP存在时又会解离成G-肌动蛋白,肌动蛋白的作用是与原肌球蛋白及肌原蛋白结合成细丝,在肌肉收缩过程中与肌球蛋白的横突形成交联(横桥),共同参与肌肉的收缩过程。
3.肌动球蛋白
肌动球蛋白是由肌球蛋白与肌动蛋白结合构成的蛋白质,具有双折射性;具ATP酶的活性,但与肌球蛋白ATP酶有所不同,Ca2+、Mg2+离子均能使其活化。肌动球蛋白在离子强度为0.4以上的盐溶液中处于溶解状态。浓度高的肌动球蛋白溶液易发生胶凝。将接近中性的肌动球蛋白溶液稀释到较低的离子强度,如0.1 mol/L KCl以下,则肌动球蛋白成絮状物,此时添加少量ATP,则絮状物收缩而形成凝胶沉淀,这样的沉淀现象称为超沉淀,此时添加KCl则沉淀再次溶解,或添加大量ATP,絮状肌动球蛋白发生溶解,此反应称为清除反应。
4.原肌球蛋白
原肌球蛋白占肌原纤维蛋白的4%~5%,形为杆状分子,长45 nm,直径2 nm。其位于F-actin双股螺旋结构的每一沟槽内,构成细丝的支架。每1分子的原肌球蛋白结合7分子的肌动蛋白和1分子的肌原蛋白,分子量65 000~80 000。(https://www.xing528.com)
5.肌钙蛋白
肌钙蛋白又叫肌原蛋白,占肌原纤维蛋白的5%~6%,肌原蛋白对Ca2+有很高的敏感性,并能结合Ca2+,肌原蛋白有三个亚基,有各自的功能特性:钙结合亚基(Tn-Ca),是Ca2+的结合部位;抑制亚基(Tn-I)能高度抑制肌球蛋白中ATP酶的活性,从而阻止肌动蛋白与肌球蛋白;原肌球蛋白结合亚基(Tn-T),能结合原肌球蛋白,起连接作用。
6.M-蛋白
M-蛋白占肌原纤维蛋白的2%~3%,存在于M线上,其作用是将粗丝连接在一起,以维持粗丝的排列。
7.C-蛋白
C-蛋白约占2%,是粗丝的一个组成部分,结合于轻酶解肌球蛋白(LMM)部分。功能是维持粗丝的稳定,有调节横桥的功能。
8.肌动素
肌动素也称辅肌动蛋白,目前发现有辅肌动蛋白-1、2、3和4四种类型,呈细胞或组织特异性分布,这四种蛋白的共同结构特征是在细胞内均为反向平行的二聚体,并具有N末端肌动蛋白结合结构域(ABD)、血影蛋白样中央重复结构域和C末端EF手性结构域,作为细胞骨架中一种重要的肌动蛋白交联蛋白,辅肌动蛋白通过与其相关蛋白包括整合素(integrins)、钙黏素(cadherin)以及细胞信号传导通路中的信号分子等的协同作用,在稳定细胞黏附、调节细胞形状及细胞运动中发挥着重要作用,因此,肿瘤的发生、发展和恶化与辅肌动蛋白的结构、功能密切相关。
9.I-蛋白
I-蛋白存在于A带,可以阻止休止状态的肌肉水解ATP。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




