1)磷酸亚铁锂
(1)性质及用途
磷酸亚铁锂(Lithium iron phosphate,又称磷酸铁锂、锂铁磷,简称LFP),分子式是LiFePO4,分子量为157.76。 其理论容量为167 mA·h/g,相对金属锂的电极电位约为3.4 V 左右,理论能量密度为570 W·h/kg。 在自然界以一种磷酸铁锂矿(Triphylite)存在,化学合成的LFP是一种锂离子电池的正极材料,优点是不含钴等贵重元素,原料价格低。 磷、锂、铁在地球含量丰富,不会有供料问题。
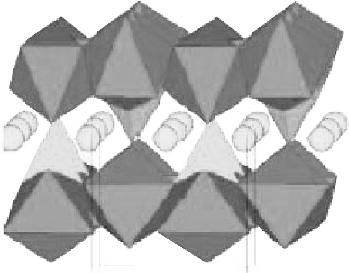
图7.1 橄榄石型LiFePO4 的晶体结构
LiFePO4 的晶体结构如图7.1 所示。 磷酸亚铁锂中心铁离子与周围的6 个氧形成共角的八面体FeO6,而磷酸根中的磷与四个氧原子形成以磷为中心的四面体PO4。 借铁的FeO6 八面体和磷的PO4 四面体所构成的空间骨架,共同交替形成“Z”形的链状结构,而锂离子则占据共边的空间骨架中所构成的八面体位置。 属于斜方晶系,其晶格常数为a =600.8 pm,b =1 033.4 pm,c=469.3 pm。 由于结构中的磷酸基对整个材料的框架具有稳定的作用,使得材料本身具有良好的热稳定性和循环性能。
LiFePO4 中的锂离子不同于传统的正极材料LiMn2O4 和LiCoO2,具有聚阴离子三维支撑骨架,在充放电过程中可以可逆地脱出和迁入并伴随着中心金属铁的氧化与还原。 其锂离子迁入、脱出的反应如下所示:
![]()
锂离子脱出后,生成相似结构的FePO4,但空间群也为Pmnb。 晶格常数为a =579.2 pm,b=982.1 pm,c=478.8 pm,锂离子脱出后,晶格的体积减小,这一点与锂的氧化物相似。 而LiFePO4 中的FeO6 八面体共顶点,因为被PO4 四面体的氧原子分隔,无法形成连续的FeO6 网络结构,从而降低了电子传导性。 另一方面,晶体中的氧原子接近于六方最密堆积的方式排列,因此对锂离子仅提供有限的通道,使得室温下锂离子在结构中的迁移速率很小。 在充电的过程中,锂离子和相应的电子由结构中脱出,而在结构中形成新的FePO4 相,并形成相界面。 在放电过程中,锂离子和相应的电子嵌入结构中,并在FePO4 相外面形成新的LiFePO4相。 因此对于球形的正极材料的颗粒,不论是嵌入还是脱出,锂离子都要经历一个由外到内或者由内到外的结构相的联换过程,材料在充放电过程中存在一个决定步骤,也就是产生LixFePO4/Li1-xFePO4 两相接口。 随着锂的不断嵌入、脱出,接口面积减小,当到达临界面积后,生成的FePO4 电子和离子导电率均低,成为两相结构。 因此,在大电流条件下,位于粒子中心的LiFePO4 得不到充分利用。
LFP 电池和一般锂电池同为绿色环保电池,但两者最大不同点是LFP 电池完全没有过热或爆炸等安全性顾虑,再加上电池循环寿命约是其他锂电池的4 ~5 倍,高于其他锂电池8 ~10 倍的高放电功率(可瞬间产生大电流),加上同样能量密度下整体重量,较其他锂电池减小约30% ~50%。 因此受到军事、汽车、电池等与电能相关领域的重视,锂电池厂纷纷投入这种新型动力锂电池的生产,目标市场就是电动自行车与电动公交车。
(2)生产原理
①固相合成法的原理:固相合成法主要是把原料充分碾磨后,在还原或惰性气体保护下,高温(300 ~350 ℃和500 ~700 ℃两步)煅烧而成。 所用原料中,锂源有氢氧化锂、碳酸锂、磷酸锂;磷源有磷酸、磷酸氢铵、磷酸亚铁、磷酸锂等;铁源主要有草酸亚铁、醋酸亚铁、磷酸亚铁和硫酸亚铁。 根据所用原料不同,其反应过程不一。 碳热还原法在原料中添加了碳,使系统中的二价铁离子免受氧化,主要反应如下:
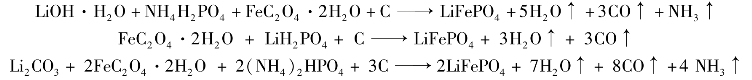
②液相法的生产原理:液相法是将锂、铁、磷原料溶解,分别配成溶液,再于常压或一定压力下共沉淀反应得到LFP 沉淀,因此原料往往为可溶性物质。 锂源为氢氧化理、硝酸锂等;磷源有磷酸、磷酸氢铵等;铁源有草酸亚铁、硫酸亚铁等。 其中,水热反应是一种典型液相制LFP 的反应,反应式如下:
![]()
(3)主要生产工艺
①固相合成法:
a.高温固相法:高温固相法是一种比较成熟的制备LiFePO4 的生产技术,可分为一步、二步和三步加热法。 制得的产品放电性能可以达到160 mA·h/g。
高温固相法设备和工艺简单,便于工业化生产,但该法的制备周期较长,产物颗粒较大,粒度分布较宽,此外,在烧结过程中需要耗费大量的惰性气体来防止亚铁离子的氧化,这也是高温固相法明显的缺点之一。
b.机械化学法:机械化学法通过机械力的作用使颗粒破碎,从而增大反应物的接触面积和新生表面活性,便于离子的迁移并促进电化学反应的进行。 制得的LiFePO4/C 复合材料的放电容量可以达到156 mA·h/g。
机械化学法虽然工艺简单,但制备的产物物相不均匀、粒度分布范围较宽,因此还有待于进一步改进。
c.微波法:微波合成是指将微波转变成热能,从材料的内部对其整体进行加热以实现快速升温的过程。 该方法制备的碳包覆产物在0. 1C 倍率下的初始放电容量可以达到161 mA·h/g。
微波合成法具有反应时间短(2 ~20 min)、能耗低、合成效率高等优点。 但该法合成的产物粒度通常只能控制在微米级左右,粉末形貌稍差。
d.碳热还原法:碳热还原法是一种能降低生产成本和颗粒大小,提高产物纯度和电导率的新型制备方法。
所以,固相合成虽然是较成熟的制备方法,但对于合成LiFePO4 仍存在许多问题。 首先,反复高温烧结和研磨虽然能改善产物的均匀度,但产物颗粒较大,不利于其电化学性能的提高;此外,合成过程中需要使用大量惰性气体和还原气体,能源消耗较大,给大规模生产操作带来不便,因此,从商业化角度考虑也需要进一步改进固相法或寻找能替代固相法的合成方法。 固相合成法的一般工艺路线如图7.2 所示。
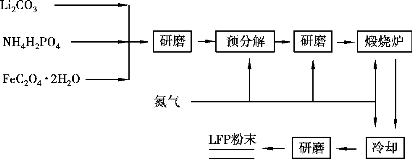
图7.2 高温固相法合成LFP 流程图
②液相合成法:
a.溶胶凝胶法:该工艺是在反应过程中使体系成为凝胶状,反应结束后煅烧得到产品,其电容量最大可以达到理论容量的95%左右。
凝胶法具有化学均匀性好、凝胶热处理温度低、粉体粒度小且分布窄等优点,但此法干燥收缩大、合成工艺较复杂,若要工业化生产尚有一定难度。
b.共沉淀法:首先,磷酸和氢氧化锂在脱除空气的去离子水中反应生产磷酸三锂沉淀,加少许硝酸溶解初始沉淀物。 把硫酸亚铁研磨后添加到上述溶液中,用氢氧化钠把溶液pH 值调整到9.0,沉淀物离心过滤并洗涤,室温下,真空干燥12 h。 干燥得到的物料在惰性气体保护下研磨,并在600 ℃下煅烧5 h 后得到LFP 产品。 共沉淀法不仅可以缩短高温煅烧反应时间、减少能耗,而且其制备的材料活性大、粒度小且分布均匀。 但此方法因不同原料要求具有相似的水解或沉淀条件而限制原料的选择,影响其实际应用。
c.水热法:水热法是通过高温高压在水溶液或水蒸气等流体中进行化学反应制备出粉体的一种方法,再在氮气保护下于高温下煅烧得到产品。 该产品的放电容量可以达到163 mA·h/g。(https://www.xing528.com)
2)磷酸钒锂系
(1)性质及用途
磷酸钒盐电极材料工作电位高(平均电位约为4. 0 V)、容量大(理论比容量达197 mA·h/g,实际可逆容量达170 mA·h/g)、导电性好,且具有特殊的三维离子通道,锂离子能很好地进行脱嵌,存在多个充放电平台。 磷酸钒锂盐热稳定性很强,它是一种聚阴离子盐,P—O 键非常强,材料热力学稳定,不会释放出氧气,同时磷酸钒盐独特的晶体结构决定了其在充放电过程中晶格形变小,材料结构稳定,安全且循环寿命极长。 该类材料往往耐高温、遇热不分解,在电池过充或短路的情况下其物化特性极其稳定,即使在电池滥用时,磷酸钒盐也不会因热释放或热失控而引起电池燃烧,因此磷酸钒盐正极材料被认为是目前安全性能最好的材料之一。 磷酸钒锂系正极材料主要有:Li3V2(PO4)3、LiVPO4F、VOPO4、LiVOPO4、Li2VPO6 和LiVP2O7 等。
(2)生产原理
在钒系磷酸锂盐二次锂离子电池负极材料中,单斜晶系的Li3V2(PO4)3 是最重要、性能最好的电极材料,以下主要对该材料的生产原理和制备方法做简要概括。
①固相合成法的原理:Li3V2(PO4)3 的合成工艺路线很多,所用的原料各异,锂源主要有氢氧化锂、碳酸锂、磷酸锂、醋酸锂;磷源有磷酸、磷酸铵、磷酸锂等;钒源主要有偏钒酸铵、五氧化二钒等。
由于固相法所用的钒属于+5 价,在高温合成过程中,必须把V5+转化为V3+才能制备出Li3V2(PO4)3。 所以,根据所用还原剂不同,该工艺又分为碳还原法和氢气还原法。
a.还原法:与LFP 制备方法一样,为了使原料中的反应气体不影响产品的性能,该工艺主要分两步进行:预焙烧(300 ~350 ℃)和煅烧(800 ~900 ℃)合成。 合成Li3V2(PO4)3 的有关化学反应如下:
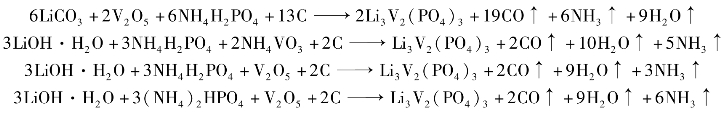
从节约成本考虑,由以上反应式可以看出碳还原工艺合适的原料为氢氧化锂、磷酸铵和五氧化二钒。
b.氢还原法:与碳还原法一样,该工艺是采用氢气代替碳作为还原剂。 该工艺主要分两步进行:预焙烧(300 ~350 ℃)和煅烧(800 ~900 ℃)合成。 合成Li3V2(PO4)3 的有关化学反应如下:

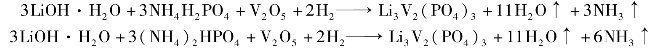
从节约成本考虑,由以上反应式可以看出氢气还原工艺合适的原料为氢氧化锂、磷酸铵和五氧化二钒。
②溶胶凝胶法的生产原理:固相法在混料时容易产生不均相,制备的产品中有杂相出现。随着研究人员对固相法不断深入研究,在此基础上又派生一些其他方法,这些方法主要是在混料上的改进。 即把原料与有机物混合,这些有机物主要有醋酸、草酸、蔗糖和柠檬酸等。 添加有机溶剂使反应原料在焙烧前形成混合均匀的溶胶,然后再进一步按照固相法的工艺路线制取Li3V2(PO4)3 产品。
举例:利用柠檬酸(C6H8O7)作为分散剂的有关化学反应如下:
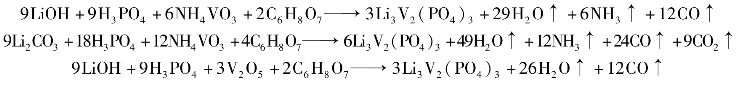
(3)主要生产工艺
与磷酸亚铁锂的生产方法一样,磷酸钒锂的合成主要包括:固相法和液相法两大类。
①高温固相法:高温固相法是制备锂离子材料常用方法,高温固相法制备工艺易于工业化。 制备磷酸钒锂的高温固相法又可以分为氢气还原法和高温碳热还原法。
a.氢气还原法:其所用的原料主要是V2O5、Li2CO3、NH4H2PO4 或(NH4)2HPO4。 操作分两步进行,首先将各种原料按化学计量比混合均匀,研磨均匀后,置于惰性气氛条件下,控制一定的升温速度,在300 ~350 ℃预焙烧6 ~8 h,以消除挥发性气体对高温反应的影响;然后,预焙烧物冷却后,压制成片状,再将片状物在氢气或氢气惰性气体混合气氛下高温(800 ~850 ℃)反应15 ~20 h,自然冷却,将产物研磨后即得产品。 Saidi 等利用纯氢气作为还原剂,制备出的单斜结构的磷酸钒锂,该材料在电压3.0 ~4.3 V,0.05 C 倍率下的容量达到了125 mA·h/g;而在3.0 ~4.8 V,0.05 C 倍率下,可逆容量达到了170 mA·h/g。
b.高温碳热还原法:所用原料与氢气还原法差不多,步骤也一致。 只不过是将碳(乙炔黑、活性炭、炭黑等)代替氢气作为还原剂。 碳作为还原剂的主要好处就是可以为Li3V2(PO4)3晶相的形成提供成核点,从而抑制了Li3V2(PO4)3 晶核的长大,有利于获得颗粒较小的样品,并且残留的碳有助于提高材料的导电率。 Saidi 等人以V2O5、Li2CO3、NH4H2PO4为原料按照化学计量比与过量25%的乙炔黑混合均匀,通过预焙烧除去水和氨气后,再混合后压制成片状,然后在氩气气氛下600 ℃焙烧8 h,再在850 ℃焙烧8 h,冷却后即可得Li3V2(PO4)3/C复合材料,该材料在3.0 ~4.3 V 范围内,0.05 C 倍率下容量为130 mA·h/g。
②溶胶凝胶法:溶胶凝胶法是在高温固体法的基础上改进而来,工艺主要分3 步进行。第一步,凝胶的制备。 不同的工艺制备凝胶的方法不同,溶胶在60 ~90 ℃下充分混合反应,最后将溶胶于100 ℃下干燥,得到凝胶待用。 第二步,在惰性气体保护下,凝胶在300 ~350 ℃下预分解,使其中的气体生成物尽量逸出,预分解结束后,冷却,充分研磨压片成型。 第三步,把成型后的预分解物置于高温炉内,在700 ~800 ℃下煅烧4 ~8 h,煅烧结束后,冷却、研磨得到产物Li3V2(PO4)3。
3)氟化磷酸盐正极材料
氟化磷酸盐系聚阴离子材料是近几年一类新型的锂离子电池正极材料。 这类材料具备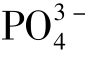 聚阴离子基团所形成的稳定框架结构,因而具有良好的结构稳定性,且因结合了
聚阴离子基团所形成的稳定框架结构,因而具有良好的结构稳定性,且因结合了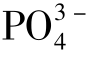 的诱导效应和F -的强电负性,显示出更高的电压,因而成为非常有潜力的高电压正极材料。在氟化磷酸盐正极材料中,研究最早、相对最成熟的要数钒基化合物,如LiVPO4F、Na3V2(PO4)2F3、Li5V(PO4)2F2 等,其他过渡金属氟化磷酸盐主要集中在Fe、Mn、Co、Ni 基系列。
的诱导效应和F -的强电负性,显示出更高的电压,因而成为非常有潜力的高电压正极材料。在氟化磷酸盐正极材料中,研究最早、相对最成熟的要数钒基化合物,如LiVPO4F、Na3V2(PO4)2F3、Li5V(PO4)2F2 等,其他过渡金属氟化磷酸盐主要集中在Fe、Mn、Co、Ni 基系列。
基于锂离子电池靠Li +的可逆脱嵌的工作机理,传统的锂离子电池正极材料仅限于锂基材料的范围。 研究发现,某些钠离子化合物作为锂离子电池的正极材料也具有优良的电化学性能,较为熟知的钠基氟化磷酸盐正极材料有NaVPO4F、Na3V2(PO4)2F3 和Na2FePO4F 等。 这突破了锂离子电池正极材料必须是含锂化合物的传统观念,使得正极材料的选择更加丰富多样,这对于合理优化资源配置、减少锂离子电池对锂资源的过分依赖无疑具有很好的促进作用。 与LiVPO4F 对应的NaVPO4F 最早被提出,它和LiVPO4F 具有相似的结构特点,在此不做详述。
(1)Na3V2(PO4)2F3 的特性
Na3V2(PO4)2F3 是继 NaVPO4F 后较早被开发的用作锂离子电池正极材料。Na3V2(PO4)2F3 属于四方晶系,空间群为P42/mnm,晶胞参数为a =b =9.038 Å,c =10.748 Å。 Na3V2(PO4)2F3 整体呈网状结构,由[V2O8F2]双八面体与[PO4]四面体通过氧原子交替连接而成,而[V2O8F2]双八面体则是两个[VO4F2]八面体通过共用一个氟原子形成,三个Na +占据两个晶体学位置,晶体结构如图7.3 所示。 Na3V2(PO4)2F3 和同属NASICON 型聚阴离子化合物的Li3V2(PO4)3 一样拥有较高的离子导电率。
图7.3 Na3V2(PO4)2F3 沿c 轴方向的晶体结构示意图
(2)A2 MPO4 F 的特性
除了钒基氟化磷酸盐化合物外,其他过渡金属系列的氟化磷酸盐A2MPO4F(A =Li,Na;M=Co,Ni,Fe,Mn)也被陆续报道用作正极材料。 由于离子大小造成的介导相互作用和磁性相互作用,A2 MPO4 F 有3 种不同的晶体结构。 包括层状的Na2FePO4F、Na2CoPO4F,“堆积型”的Li2CoPO4F、Li2NiPO4F,以及三维结构的Na2MnPO4F。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




