1)湿法磷酸生产化学反应
湿法磷酸的生产方法是在一定的条件下,用酸分解磷矿制磷酸,分解的过程中生成磷酸溶液和难溶性硫酸钙结晶。 湿法磷酸生产化学反应,总的化学方程式如下:
![]()
实际上反应分两步进行。 第一步是磷矿和循环料浆进行预分解反应,磷矿首先溶解在磷酸中生成磷酸一钙。
![]()
第二步为上述的磷酸一钙料浆与过量的硫酸反应生成硫酸钙结晶和磷酸溶液。
![]()
硫酸钙以3 种不同的结晶形式从磷酸中沉淀出来,它们的生成条件主要取决于磷酸溶液中的磷酸浓度、温度以及游离硫酸浓度。 根据生产条件的不同,可以有二水硫酸钙(CaSO4·2H2O)、半水硫酸钙(CaSO4·1/2H2O)和无水硫酸钙(CaSO4)3 种。 相应的就有3 种不同的生产方法即二水法、半水法和无水物法。 反应中生成的HF 与磷矿中带入的SiO2 生成H2SiF6。
![]()
H2SiF6 又与SiO2反应生成SiF4气体。
![]()
以上可以知道氟主要是以SiF4 形式存在,用水吸收后生成氟硅酸水溶液并析出硅胶沉淀。
![]()
磷矿中铁、铝、钠、钾等杂质将发生以下的反应:(https://www.xing528.com)

其中,镁主要存在于碳酸盐之中,磷矿中的碳酸盐,白云石、方解石等首先被分解并放出CO2。
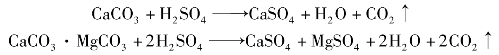
生成的镁盐全部进入磷酸溶液中,对磷酸的质量和以后的加工过程都会产生一定的影响。
2)湿法磷酸生产过程中的相平衡
硫酸钙在湿法磷酸生产中可能生成的3 种结晶有不同的溶解度等温线。 研究其溶解度曲线,可以了解不同晶体的磷酸钙在磷酸中的稳定情况,如果结晶的溶解度越小,则其稳定性越大,而这种稳定性是湿法磷酸生产工艺过程中的重要依据。
以下讨论的半水物系指的是α-半水物,无水物系指无水物Ⅱ。 80 ℃时,硫酸钙3 种水合结晶在磷酸中,无水硫酸钙结晶在所有的磷酸浓度的溶液中溶解度最小,成为唯一的稳定固相;二水物和半水物都是介稳定态最终将转化为无水物。 二水物和半水物结晶的稳定性取决于温度及磷酸的浓度。 80 ℃时,相应的磷酸浓度为33%P2O5,所以在该温度下当溶液的磷酸浓度低于33%P2O5时,二水物的溶解度比半水物小,相对的比半水物更稳定;反之高于33%P2O5时,半水物比二水物更为稳定,33%P2O5二水物比半水物稳定的转化平衡点,对不同的生产要求可以按三元体平衡的转化规律来进行不同的选择。 为了便于研究现将硫酸钙的三元体系平衡图绘制如图2.1 所示。
在如图2.1 所示的3 个区域中,硫酸钙的结晶的转化顺序为:
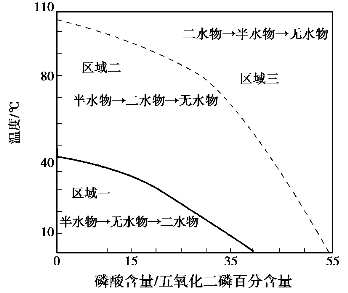
图2.1 CaSO4-H3PO4-H2O 三元体系相平衡图
区域一:半水物→无水物→二水物
区域二:半水物→二水物→无水物
区域三:二水物→半水物→无水物
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




