当金属与电解质溶液接触时,由电化学反应而引起的腐蚀叫电化学腐蚀。如金属在潮湿大气中,以及在土壤及海水中腐蚀都是电化学腐蚀。
电化学腐蚀的特点是形成了腐蚀电池或原电池。暴露在空气中的金属表面上将凝结空气中的水分,形成一层极薄的水膜,水膜或可能吸收空气中的二氧化碳或氧气形成电解液,这种情况下,相当于将两种金属放在电解液在形成腐蚀电池。电极电位较低部位作为阳极进行氧化过程,电位低的金属上电子移向电位高的地方发生腐蚀;电位较高的部位作为阴极,进行还原过程。
电化学腐蚀一般为析氢腐蚀、吸氧腐蚀。
1.析氢腐蚀
在酸性介质中金属易发生析氢腐蚀。
在电极电位较低的部位,金属M作为阳极发生腐蚀:
M-ne→Mn+
在电极电位较高的部位,作为阴极发生析出氢气的电极反应:(https://www.xing528.com)
2H++e→H2↑
2.吸氧腐蚀
在碱性介质中(或中性)甚至微酸性介质中易发生吸氧腐蚀(故大气腐蚀一般是吸氧腐蚀):
阳极:M-ne→Mn+
阴极: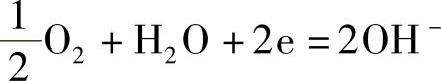
如埋在地下金属,有的处于砂土部分与有的处于黏土部分。砂土部分氧气比较容易渗入,而黏土部分氧气不易渗入。这样,埋在砂土部分的金属接触氧气浓度(或分压)高,而埋在黏土部分金属接触氧气的浓度(或氧气的分压)低,导致该处金属电极电位较低被腐蚀,而砂土部分发生吸氧反应。这种腐蚀是由于金属表面因氧气分布不均匀而引起腐蚀,因此也称差异气体腐蚀,
影响电化学腐蚀速度主要是极化和钝化。极化是电流通过电极时,电极电动势偏离平衡电位的现象。对于阳极(腐蚀金属),极化作用使金属电极电位变大,而对应阴极电极电位变小,结果使腐蚀速度减慢。电位较负的金属由易腐蚀状态转变耐腐蚀的钝性状态称为钝化。由钝化状态转变为易腐蚀状态称去极化。一般来讲,当电解质中存在的卤离子,H+常破坏钝态;在温度高时,钝化困难,或易破坏钝化;在中性或碱性时,易发生钝化,但对于两性金属Al、Zn在碱性时易破坏钝化。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




