一摩尔物质升高1K所需的热量称摩尔热容。金属的摩尔热容是1克原子金属升高1K(度)所需的热量又称为金属的原子热容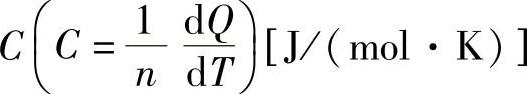 。显然,数值上等于金属比热容和原子量A的乘积:
。显然,数值上等于金属比热容和原子量A的乘积:
CV=cVA或Cp=cPA
根据单原子理想气体的分子热容动力学原理,理想气体在运动时,只有平动的动能,属于一个自由度的平均动能为 ,由于在三个自由度下,故动能等于
,由于在三个自由度下,故动能等于 。在固体中确定热容,不仅要考虑动能,还要考虑振动着的原子位能。位能又等于动能,总的能量为3kNT。
。在固体中确定热容,不仅要考虑动能,还要考虑振动着的原子位能。位能又等于动能,总的能量为3kNT。
因此,1g原子的内能应等于3kNT,即
U=3kNT
故,固体的原子热容为

这表明,克原子的热容是常数,数值等于24.9J/mol·K,这就是杜隆-珀替定律。
但是,固体的摩尔热容实验事实如下:
1)在室温范围内,几乎所有单原子固体(包括金属)热容的值接近于3R即24.9J/mol·K,这与杜隆-珀替定律一致。
2)在低温下,固体的热容显著下降,对于绝缘体,依T3趋于0。对于金属按T趋于0,或更确切是CV=γT+AT3(γ、A与材料有关的常数)。
显然在低温下,固体金属的原子热容并不是常数,而是与温度有关,温度越低,热容越低。
为了确定固体低温下的热容,费米提出了费米模型,推出金属的热容为
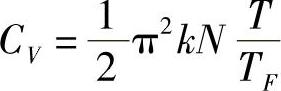
式中 TF——费米温度,与物质本性有关的常数。应当指出利用费米模型推导金属热容时,只考虑了自由电子对热容的贡献。(https://www.xing528.com)
1912年德拜提出德拜模型,推导出了晶体的热容公式:

式中 θD——德拜特征温度,决定于晶体物质的本性。
当T≫θD时: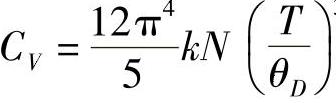 ,即温度很低时,晶体的热容与温度的三次方成正比,这就是德拜定理。
,即温度很低时,晶体的热容与温度的三次方成正比,这就是德拜定理。
当T≪θD时:CV=3kN,这与杜隆-珀替定律一致。
同样应当指出,在德拜模型中没有考虑电子对热容的贡献。在很低的温度下,电子的热容不像离子(或原子振动)热容急剧衰减。在温度比德拜温度和费米温度低得多的情况下,金属的热容是电子热容和离子热容的两者贡献之和,即
CV=rT+AT3
式中 r、A——标志材料特征的参数。
上式中,第一项为自由电子对热容的贡献,与T成线形关系,可由费米公式计算出来,并且在足够低的温度下占主要地位。第二项为金属离子(或原子振动)对热容的贡献,与T3成正比,可由德拜公式计算出来。由于费米温度比德拜温度高约两个数量级,所以只有在极低的温度下,金属的比热容与T成线形关系。例如低温时:
CCu=0.888×10-4RT+CV′
CAL=1.742×10-4RT+CV′
在很宽的温度范围内,金属摩尔热容随温度的变化基本可分为三个区域。当温度接近0K时,金属摩尔热容与温度呈正比;当温度较高时,金属摩尔热容与温度无关,近似等于3R(见图2-8)。

图2-8 铜的摩尔热容随温度的变化曲线
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




