两组元元素A和B组成合金时,除了可以形成以A为基或以B为基的固溶体外,当超过固溶体的溶解度时,还可以形成晶体结构不同于该两组元的新相。新相可有很多类型,它在二元相图上所处的位置总是在两个固溶体区域的中间部位,所以通常把这些合金相称为中间相。
中间相的类型很多,分类也不一致,主要包括服从原子价规律的正常价化合物(如Mg2S、ZnS),取决于电子浓度的电子化合物,及小尺寸原子与过渡金属之间形成的间隙相和间隙化合物等。这是一类不包括固溶体和金属化合物的相,成分往往可以在一定范围内波动,不能以单一的化学式来表示,多数是金属之间或金属与类金属之间的化合物,其结合以金属键为主,仍保持金属特性的合金相。
1.电子化合物
电子化合物是由两种金属组成的:一种为一价的金属(Cu、Ag、Au、Li、Na)或过渡金属(Mn、Fe、Co、Ni、La);而另一种为普通的二至五价的金属(Be、Mg、Zn、Cd、Hg、Al、Si、Sn、Sb、As)。这种化合物的特点是价电子数与原子数之间具有一定的比例[3∶2;21∶13;7∶4等],每一比例与一定的晶体结构相对应。
电子浓度比为21∶14(或3∶2),如:CuZn(3∶2)、Cu3Al(6∶4)、Cu5Sn(9∶6),晶体结构都是体心立方,称为β相;
电子浓度比为21∶13,如Cu5Zn8,具有复杂立方结构,称为γ相如γ黄铜;
电子浓度比为21∶12(或7∶4),如CuZn3、AgAl3,具有密排六方结构,称为ε相。
可见决定合金结构的是电子浓度,故称为电子化合物。另外组元的半径及化学性质等因素,也会影响化合物的结构。(https://www.xing528.com)
同时应当指出,电子化合物虽然可用化学式表示,但实际上,它的成分在一定范围内变化着。因此电子浓度实际也是一个范围。
2.间隙相与间隙化合物
过渡金属元素能与氢、碳、氧、氮等原子半径小于0.1nm的元素形成的金属化合物。当金属(M)与非金属(X)的原子半径比值rx/rM<0.59时,化合物具有比较简单的结构,称为间隙相。而当rx/rM>0.59时,其结构很复杂,通常称为间隙化合物。它们都具有金属的性质,有很高的熔点和极高的硬度,称为硬质合金。
间隙相具有比较简单的结构。金属原子位于面心立方、体心立方或密排六方的正常结构上,而原子半径很小的原子则位于该结构的间隙位置,从而构成一种新的晶体结构。
例如,间隙相VC(见图1-25):钒原子位于面心立方正常结点上。而碳原子则有规则地分布在面心立方的八面体间隙位置上,构成NaCl型结构,八面体间隙数与金属原子数相等,钒与碳原子数大致相等。
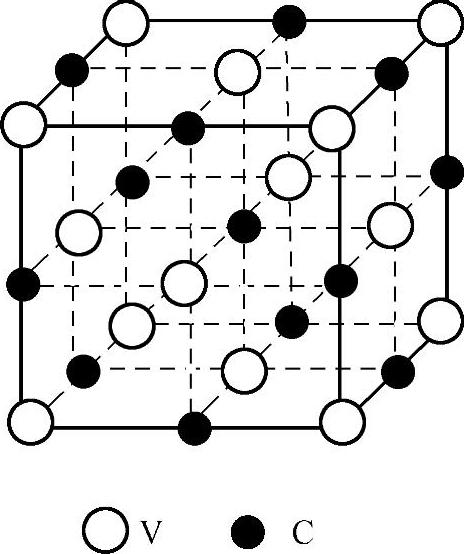
图1-25 间隙相VC的晶体结构
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




