间接交换作用通常在氧化物(如铁氧体)和稀土金属及其合金中存在。不过铁氧体和稀土金属中的间接交换作用又不相同。
1.稀土金属化合物中的间接交换作用
稀土金属中对磁性有贡献的4f电子是局域化的。4f电子层半径为0.05~0.06nm,外层的5p65d16s2电子对4f电子起屏蔽作用。相邻原子的4f电子云不重叠,不可能存在直接交换作用。茹德曼(Ruderman)、基特尔(Kittel)、胜谷(Kasuya)和良田(Yosida)等人提出了导电电子与内层电子的交换作用理论,称为RKKY理论。RKKY理论中心思想是:在稀土金属中4f电子是局域的,6s电子是游动的。f电子与s电子发生交换作用,使s电子极化,这个极化了的s电子的自旋对f电子自旋取向有影响,结果形成了以游动的s电子为媒介,使磁性离子的4f电子自旋与相邻的离子的4f电子自旋存在间接交换作用,从而产生自发磁化。
在稀土金属间化合物中,例如富3d过渡族化合物,如ReM5、Re2M5等已成为重要的永磁材料。这类化合物的晶体结构都是由CaCu5型六方结构派生出来的。其中ReM5,如ReCo5的结构与CaCu5的结构相同,如图7-8所示。在这类化合物中R-R和R-M原子间距都较远,无论是4f电子之间还是3d—4f电子云之间都不可能有重叠。它也是以传导电子为媒介产生间接交换作用,对于原子序数小于Gd的轻稀土金属来说,3d金属原子与4f稀土金属原子磁矩平行排列,导致两种原子磁矩铁磁性耦合;而原子序数大于Gd的重稀土金属,3d金属原子与4f稀土金属原子磁矩的反平行排列,导致了两种原子磁矩的亚铁磁性耦合,如图7-9所示。
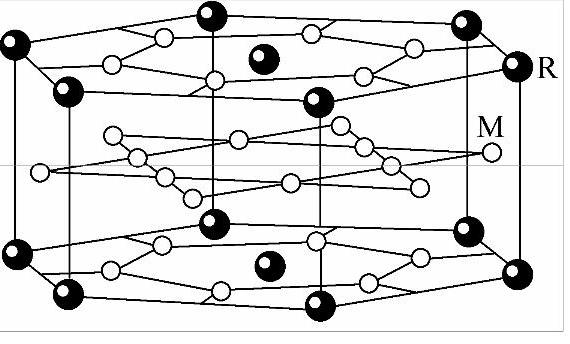
图7-8 ReM5的晶体结构
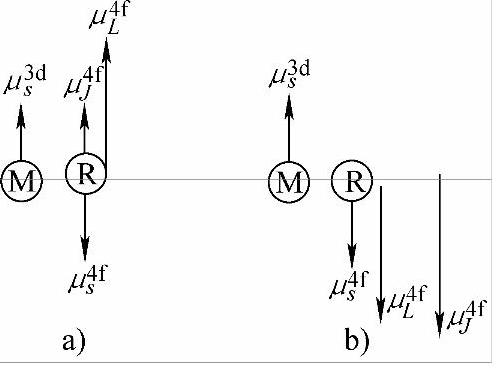
图7-9 稀土化合物中原子磁矩的耦合方式
a)轻稀土化合物 b)重稀土化合物
2.铁氧体中的间接交换作用
在氧化铁中,Fe-Fe原子间的距离是0.428nm。由于铁原子间距过大,3d电子间不可能有直接交换作用。为了解释氧化物中的自发磁化,1934年克拉默尔斯(Kramers)提出了间接交换作用(又称为超交换作用)。到了1950年安德森(Anderson)进一步完善了超交换作用理论。下面定性地作一简介。
图7-10是MnO的晶胞。图中两个斜影线画出的对角面把它分成两个磁矩相反的次晶格。它的特点是Mn2+和O2-交替地占据晶格的位置。任何一个Mn2+的最近邻都是O2-,而每一个O2-的周围又都是以Mn2+作最近邻。每一个O2-两侧(上下,左右,前后)相距为a的Mn2+的磁矩都是反平行的。另一种情况是通过O2-形成90°,间距为 的Mn2+的磁矩可能是反向的,也可能是同向的。例如图7-10中1和2同向,2和3反向。显然决定离子磁矩相对取向的不是Mn2+和Mn2+间的直接交换作用,而是通过O2-所产生的一种间接交换作用。下面分析一下Mn2+和O2-的相互作用。
的Mn2+的磁矩可能是反向的,也可能是同向的。例如图7-10中1和2同向,2和3反向。显然决定离子磁矩相对取向的不是Mn2+和Mn2+间的直接交换作用,而是通过O2-所产生的一种间接交换作用。下面分析一下Mn2+和O2-的相互作用。
一对Mn2+、O2-离子处于基态时,Mn2+离子3d5亚层的5个电子自旋方向相同,而O2-离子2p6亚层的6个电子自旋方向两两相反。O2-离子的外层电子是满的,它不可能与周围的Mn2+的3d亚层产生交换作用。但由于Mn2+的3d亚层没有填满电子,因而O2-离子的2p电子就有可能跑到Mn2+的3d层中的空穴中去。当O2-的一个电子一旦跑到Mn2+的3d层中去时,这个2p态电子就变成了3d态电子。因而系统就成了激发态。根据泡利原理,这个激发态的电子自旋磁矩就要与Mn2+的磁矩方向相反。O2-失去一个2p电子后,就变成了O-,而成为一个具有一个电子自旋磁矩的磁性离子。O-的磁矩方向仍然和激发到3d态电子的自旋磁矩的方向反向平行,这是因为考虑的激发态是一级激发态,一级激发态的电子只改变位置,而不改变方向。这时Mn+的3d6的电子自旋方向为↑↓↑↑↑↑,而O-的2p5的电子自旋方向为↑↓↑↓↑。这样就确定了Mn+和O-的磁矩方向相同。而O-是磁性离子,它与邻近的别的磁性离子Mn2+发生交换作用,从而确定它与这些近邻的Mn2+磁矩的相对取向,再间接地确定各Mn2+之间的磁矩相对取向。
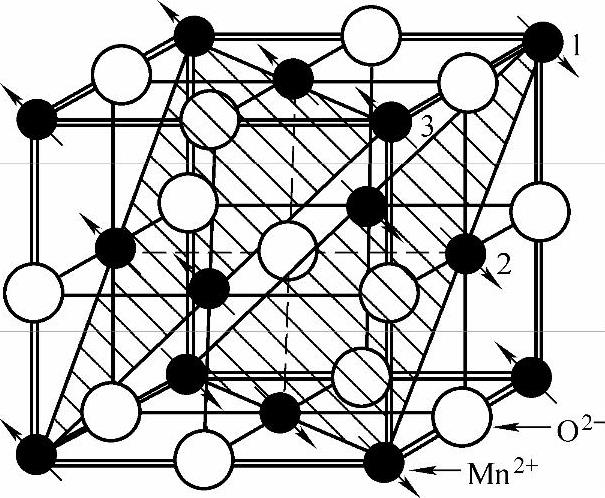
图7-10 MnO晶胞中Mn2+和O2-的分布及离子磁矩方向
因为p态电子云的角分布是“哑铃”状的。因此O2-的电子云只与其两侧成一直线的两个Mn的电子云有重叠,如图7-11所示。因此O2-的2p电子只跑到两侧的Mn2+中去,不会跑到垂直于“哑铃”方向的Mn2+中去。当O2-中的一个2p电子跑到左边的Mn2+的3d层中去时,O-就要和右边的Mn2+产生较强的交换作用,而在垂直于“哑铃”方向的交换作用很弱。这是因为O-和它右边的Mn2+的电子云重叠较多,而和垂直于这个“哑铃”方向的邻近的Mn2+的电子云几乎没有重叠。“哑铃”状分布的电子是磁量子数ml相同而自旋方向相反的两个电子。计算证明O-与右边Mn2+的交换积分A是负的,因而和右边的Mn2+的磁矩方向必定反平行。Mn+—O-—Mn2+的磁矩方向如图7-12所示。因此在O2-两侧成一直线上的两个Mn2+的磁矩必然是反平行的。称这种通过氧离子而确定锰离子磁矩相对取向的交换作用为间接交换作用或超交换作用。这种交换作用就使得MnO中的Mn2+磁矩,一半向着一个方向,另一半向着相反的方向,而总的磁矩为零。固此MnO是反铁磁性的。(https://www.xing528.com)

图7-12 Mn+O-Mn2+的磁矩方向
铁氧体有三种晶体结构类型,即尖晶石型、石榴石型和磁铅石型。前者是最常见的一种。图7-13是铝镁尖晶石(MxO·Al2O3,其中M代表二价金属离子,如Mn2+、Co2+、Mg2+、Ni2+、Zn2+等)晶体的一个晶胞。可见直径大的O2-(0.265nm)占据了晶胞中大部分空间,直径比较小的金属离子Mg2+(0.156nm)和Al3+(0.116nm)嵌镶在O2-离子之间的空隙里,而且有一定的规律。在Mg2+的四周有四个最近邻的O2-,如果把这四个O2-的中心联接起来,就构成了一个正四面体。Mg2+处在这四面体的中心位置。而Al3+最近邻有六个O2-,这六个O2-的中心联线构成正八面体。Al3+处于正八面体的中心位置,如图7-14所示。分析晶胞中所有离子的相对位置,就会发现O2-之间的间隙只有这两种。称四面体中心位置为A位置,八面体的中心为B位置。占据A位置的金属离子所构成的晶格为A次晶格。占据B位置的金属离子所构成的晶格为B次晶格。
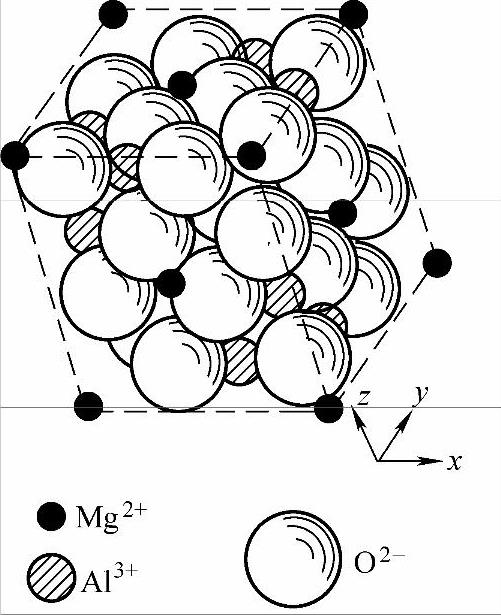
图7-13 尖晶石型晶体结构
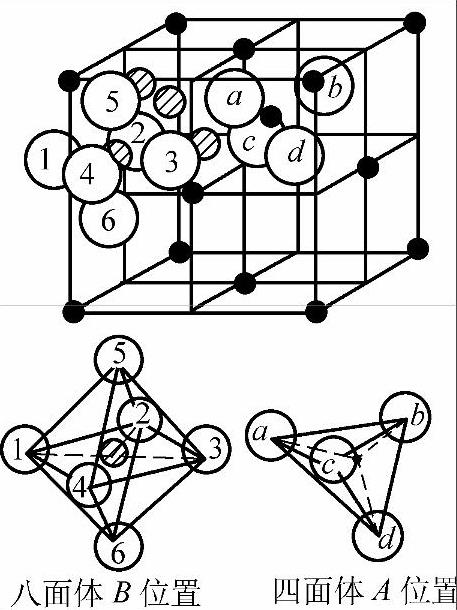
图7-14 四面体和八面体示意图
A位置或B位置的金属离子间都要通过O2-发生间接交换作用。A和B位置上离子的磁矩是反铁磁耦合,在铁氧体中往往是A、B两个位置上的磁矩不等,因而出现了亚铁磁性。例如单尖晶石铁氧体的结构式为
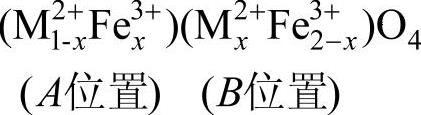
A位置上的磁矩和为[5x+mx(1-x)]μB,式中,x为原子数;mxμB为金属离子M2+的磁矩;5μB为Fe3+的磁矩。B位置上的总磁矩为[mxx+5(2-x)]μB。面分子的磁矩m为A位与B位上磁矩之差,即
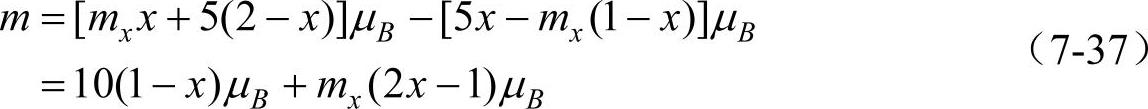
MnFe2O4和NiFe2O4分子磁矩的计算值与实验值基本相符合。
在实际使用中单铁氧体在磁性上不能满足要求,于是人们就根据实际需要将两种或两种以上的单铁氧体按一定的比例制备成多元系铁氧体,称为复合铁氧体。
铁氧体磁性材料的特点是电阻率特别高(比金属磁性材料的电阻率高100万倍),这在高频和超高频技术中应用,就有很大的优越性。另外,铁氧体的原材料来源丰富,成本低。但铁氧体的居里点偏低,温度稳定性差,Ms也较低,故在低频和高功率下一般还是用金属磁性材料。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




