在19世纪已发现了两个有关晶体热容的经验定律。一是元素的热容定律——杜隆—珀蒂定律:恒压下元素的原子摩尔热容为25J/(K·mol)。实际上,大部分元素的原子摩尔热容都接近该值,特别在高温时符合得更好。只是轻元素的原子摩尔热容与此值相差较大。另一个是化合物的热容定律——柯普定律:化合物分子热容等于构成此化合物各元素原子热容之和。
经典的热容理论可对此经验定律作如下解释。在固体中可以用谐振子代表每一个原子在一个自由度的振动。根据经典理论,能量按自由度均分,每一振动自由度平均动能是(1/2)kT(参照理想气体分子的平均动能),因为是谐振子,平均势能等于平均动能,故平均势能也为(1/2)kT。那么每一个自由度的平均能量为kT。一个原子有三个振动自由度,一个原子的平均能量为3kT。1mol固体中有N0个原子,总能量为E=3N0kT=3RT。这里N0=6.023×1023,为阿伏加德罗常数,T为热力学温度,k为玻耳兹曼常数,摩尔气体常数R=8.314J/(K·mol)。根据摩尔定容热容定义
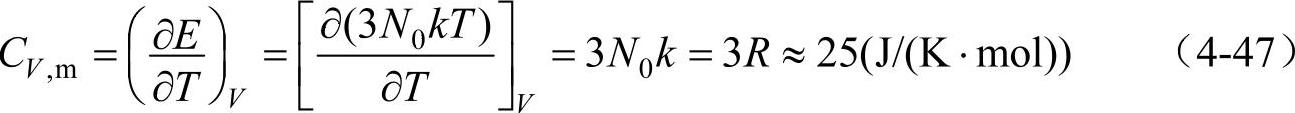
在简谐近似下,原子的振动是严格简谐的,不会发生热膨胀现象,因而定容的前提条件也成立。(https://www.xing528.com)
由式(4-47)可知,摩尔定容热容是与温度无关的常数,这就是杜隆—珀蒂定律。对于双原子的固态化合物,1mol中的原子数为2N0,故摩尔定容热容为CV,m=2×25J/(K·mol),三原子固态化合物的摩尔定容热容CV,m=3×25J/(K·mol),余此类推。杜隆—珀蒂定律在高温时与实验结果是很符合的。但在低温时,摩尔定容热容的实验值并不是一个恒量。它随温度降低而减小,在接近0K时,摩尔定容热容值按T3的规律趋于零(绝缘体)或按AT+BT3的规律趋于零(金属)。如图4-8为Cu的CV,m与T关系曲线(CV,m值不是直接测量的,而是由测量Cp,m值换算来的),曲线可分三个区,每区的特点:Ⅰ区CV,m∝T;Ⅱ区CV,m∝T3;Ⅲ区逐渐过渡为平缓上升的直线。对于低温下摩尔定容热容减小的现象使经典理论遇到了困难,需要用量子理论来解释。
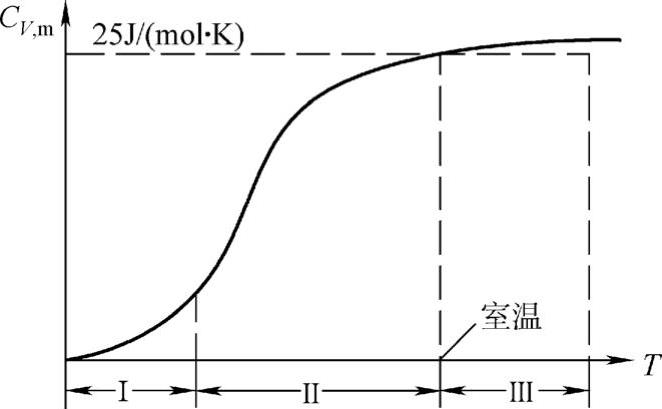
图4-8 Cu的CV,m随T变化曲线
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




