1.多电子原子体系中电子运动的描述及近似能级图
除了氢原子或类氢离子之外,所有的原子(离子)都属于多电子原子(离子)。这样的体系原则上只需在薛定谔方程中补进其他电子对核的作用能及增加所有电子与电子之间的相互作用势能项,求解即可。但难以获得精确解,只能近似解出各轨道及其能量。其解具有类似于上述氢原子解的形式,不过各轨道的能量和能级次序将不同于氢原子的轨道,并且多个电子将处于可能的不同轨道上。不同轨道电子云密集于核外的距离不同,1s电子离核最近,因此,它将有效地屏蔽原子核对其他轨道电子的作用。反之,处于其他轨道的电子对1s电子的屏蔽则显得不大有效,甚至无效。核外的其他电子的存在笼罩着原子核减小了核对指定电子的吸引力,这种现象被称为屏蔽效应。粗略地讲,对于多电子体系中指定的某个j电子而言,由于其他轨道上的电子对核的屏蔽作用,使核对j电子的吸引力减小,就好像核电荷Z减小一样,即从原来的Z减为Zj*,Zj*称为有效核电荷,为

式中σi是j电子以外的i电子对核屏蔽(影响到j电子)的常数,通常可由某些经验规律计算出来。j电子的轨道能量εnl,j(单位为J)为

此外,多电子原子中n较大的原子轨道,如4s轨道的电子有相当的几率出现在核附近,好似钻入内部,部分地回避了(n-1)层的原子轨道,如3d轨道的电子对它的屏蔽作用,却又反过来削弱了3d电子受核的吸引力。这就导致了多电子原子体系中n较小的3d电子的能量略高于n较大的4s电子的能量。这种现象称为钻穿效应,这样又进一步说明了多电子原子各电子的能量应由主量子数n与角量子数l共同来决定。
我国化学家徐光宪院士提出了描述多电子体系的原子轨道近似能级次序的(n+0.7l)规则:以该轨道的(n+0.7l)数值大小决定轨道能量之高低,并将(n+0.7l)值的第一位数字相同的各能级编成一组称为能级组,各能级组内各个轨道能级差较小,而能级组间能量差较大,外层电子所在能级组的编号恰好是化学元素所在的周期数。这样,多电子原子轨道的能量由低到高依次为:1s;2s,2p;3s,3p;4s,3d,4p;5s,4d,5p;6s,4f,5d,6p;7s,5f,6d,7p;…参见图2-6。多电子原子轨道的能量顺序反映了:l相同时,εK<εL<εM<εN<…;n相同时,εns<εnp<εnd<εnf;n和l不同时,发生能级交错,但遵循εns<ε(n-2)f<ε(n-1)d<εnp。此外,不同元素原子相应原子轨道的能量会有很大差别。
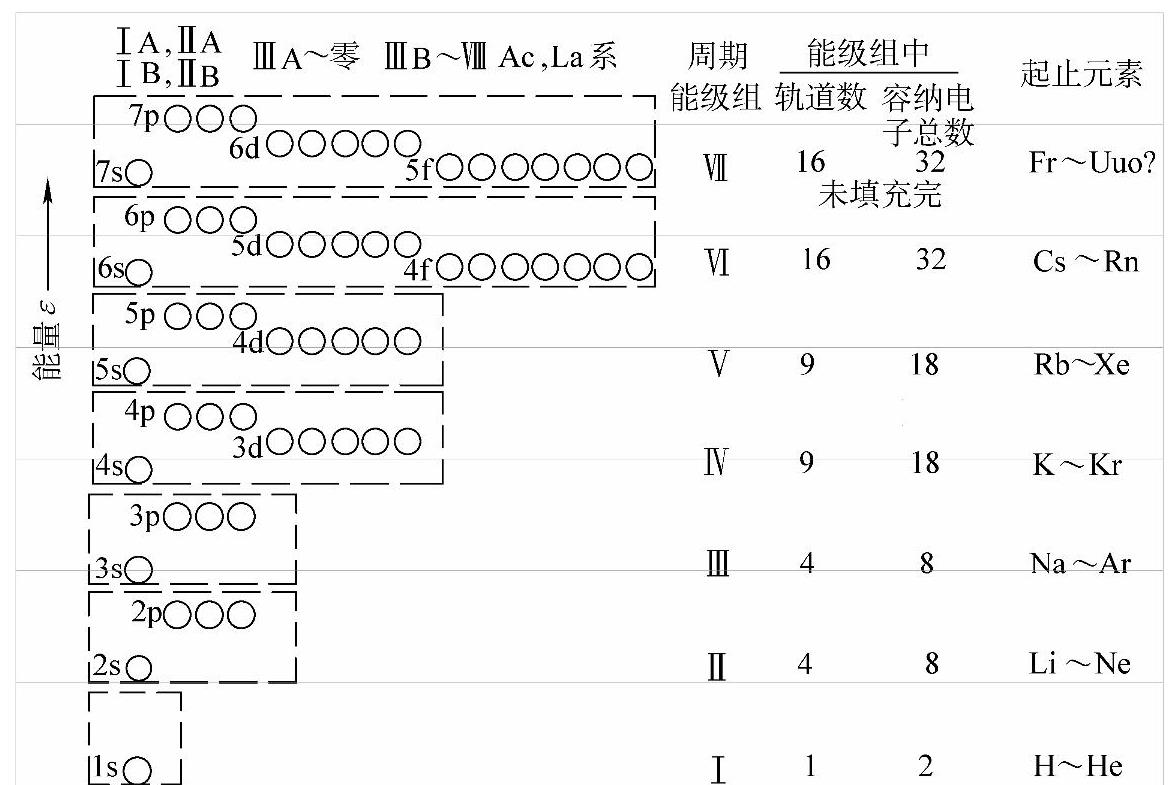
图2-6 原子轨道近似能级、能级组与周期律
2.基态原子核外电子排布遵循规律
原子处于基态时,其核外电子的排布应遵循三条重要原则。
1)泡利不相容原理 一个原子轨道最多只能容纳两个自旋相反的电子,或者在一个原子中不可能存在4个量子数(除了上面提到的三个量子数,还有自旋量子数ms,为±1/2)完全相同的两个电子。
2)能量最低原理 在不违背泡利原理的条件下,电子优先占据能量较低的原子轨道,即电子按低能轨道顺序向高能轨道逐一填充,使整个原子体系能量处于最低状态。
3)洪特规则 在等价轨道上的电子尽可能以相同的自旋方向分占不同的轨道;当等价轨道上电子处于全充满(p6或d10或f14)、半充满(p3或d5或f7)时,原子能量较低,比较稳定。
根据上述三原则,可以写出各元素基态原子的电子结构,例如Fe,原子序Z=26,则核外26个电子的构型或排布可表示为1s22s22p63s23p64s23d6。化学反应时,参与反应的只是原子的外层电子。其内层电子结构通常是不变的。不参与反应的内层电子称为原子实。可以用相应的稀有气体加方括号来表示原子实。如[He]表示了1s2的两个电子在最内层电子轨道上的排布,而[Kr]表示了1s22s22p63s23p64s23d104p636个内层电子的结构。参与化学反应的外层电子是填充在最高能级组中的有关轨道上的电子,这组轨道常常称为价电子轨道或称价轨道。占有这些轨道的电子通常就称为价电子。于是任何元素原子皆可以用:[稀有气体]价电子的方式来表示。Fe的电子结构应该表述为Fe[Ar]4s23d6。对于基态Cr原子应表示为Cr[Ar]4s13d5,而基态Cu原子则为Cu[Ar]4s13d10。根据洪特规则,半充满d5及全充满的d10电子排布比较稳定,因此Cr与Cu在4s轨道上只占有1个电子,这为光谱实验数据所确证。至于Sn(Z=50)的电子构型应表示为Sn[Kr]5s24d105p2。这里的4d10并不包括在Kr的电子构型之中。
当原子电离成为离子时,丢电子的顺序应满足n+0.4l规则,即此值越大的电子应先电离。因此在ns(n-1)d np组成的能级组中,先电离的是np电子,然后是ns电子,而(n-1)d电子最后失去。Cu原子电离时先丢失的是4s电子,然后丢失3d电子。这样Cu2+的电子结构应表示为Cu2+[Ar]3d9。
3.元素周期表与原子的电子层结构
根据元素化学和物理性质的相似性分组并按性能周期性变化规律进行排列形成的元素周期表无疑是化学史上的一个重要的里程碑。随着对原子结构研究的不断深入,逐步揭示了原子核外电子排布的规律,从而指明了元素周期律的内在原因。元素周期律是原子中电子层结构周期性变化的必然结果。分析一下周期表(参见表2-3)可得出如下关系。
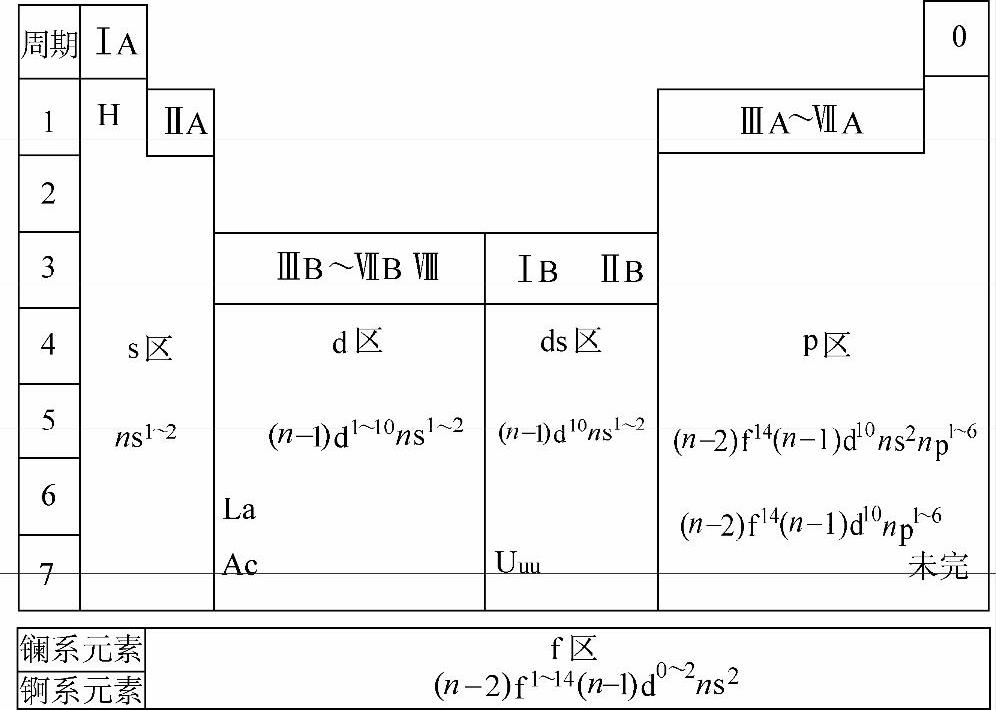
①元素所属周期是由其基态原子能量最高的电子所在的能级组的序号所规定。各周期中元素数目是相应能级组中原子轨道可容纳的电子总数。每一周期都以ns1开始,以1s2(He)或np6(Ne、Ar、Kr、Xe、Rn)为终结。因此周期表中含有一个特短周期(2种元素),两个短周期(各8种元素),两个长周期(各18种元素),一个特长周期(32种元素)和一个未完成周期(理论推测应有32种元素,1994年12月已人工合成了第111号元素)。长周期中各有10种副族元素(记以B)——过渡元素,特长周期中各含有15种内过渡元素(镧系与锕系元素)。
②主族(ⅠA~ⅦA)及副族(ⅠB~ⅡB)的族数是基态原子最高占有能级组中(ns+np)电子数,但电子构型为1s2的He及ns2np6的稀有气体(Ne,Ar,…)称零族。副族ⅢB~ⅦB族数是基态原子最高占有能级组中[ns+(n-1)d]的电子数。最高占有能级组中ns2(n-1)d6~8的电子构型有3纵列,称Ⅷ族。共有ⅠA~ⅦA、ⅠB~ⅡB、Ⅷ和零16个族。(https://www.xing528.com)
③根据原子的电子层结构特征,可把全部元素分成5个区,即s,p,d,ds和f区。s区包括ⅠA和ⅡA(碱金属,碱土金属),电子层构型是ns1~2;p区包括ⅢA~ⅦA及零族元素,电子层构型是np1~6;d区包括ⅢB~ⅦB及Ⅷ族,电子层构型为ns1~2(n-1)d1~8;ds区包括ⅠB和ⅡB族,电子层构型是ns1~2(n-1)d10;f区为La系、Ac系,各14种元素,电子构型为(n-2)f1~14(n-1)d0~2ns2。因此,已知元素原子序数即可推知其在周期表中的位置。
表2-3 原子价电子构型与周期系分区
4.元素周期性
原子结构决定着元素的性质,决定各元素原子结构特征的有三个重要因素:核外电子构型,原子核有效核电荷和原子半径。随着原子序数的递增,元素性质逐渐发生质变。但各元素性质间既存在着本质差异,又有内在联系并呈现周期性,因此元素的原子的半径、电离能、电负性和金属性等化学、物理性质有着一定的渐变规律。正因为如此,根据周期表中的位置往往可推知关于元素的许多重要信息。
(1)核外电子构型
元素的化学性质很大程度上取决于价电子构型。凡基态呈稀有气体构型,即填满p电子(np6)构型者是稳定结构。这种结构的原子具有相当的化学惰性。其他结构的原子或获取或丢失电子达到稳定结构而呈现化学活性。各族元素外层能级都有相似的电子构型。因而价态及化学性质相似。其中过渡元素,电子除填入(n-1)d或(和)(n-2)f轨道上外,常还有一两个更易丢失的ns电子,因而它们既有共同的价态,又有各自的多种氧化态,可形成多种价态的化合物,而且它们常各自呈现独特又美丽的颜色。
(2)原子半径
关于原子半径r,按近代原子结构的概念,核外电子呈几率分布,因而原子的大小无明确界限。但在单质和化合物中,元素的原子常以化学键结合在一起,因此原子的半径实际上根据测定它们的核间距离的实验结果推导而得。通常将同种相邻原子形成单键键距之半定为共价半径,在金属晶体中则称金属半径。
周期表中同周期内的主族元素自左向右核电荷逐渐增加,各元素的最后一个电子都填充在最外层上,由于同层上电子屏蔽较弱,因此有效核电荷是明显增加的,从而导致了原子半径的明显变小;若自上而下按族递增时,增加了电子层,而电子构型基本不变,因内层电子对外层电子的屏蔽较有效,因此有效核电荷的增加不显著,原子半径显著增大。副族元素自左向右递变时,各元素的最后一个电子都填充在(n-1)层上,由于较内层电子对外层电子屏蔽较强,因此有效核电荷增加不明显,因而大体上原子半径变化不大。但当次外层的d轨道全充满时由于(n-1)d10的较大的屏蔽作用而导致原子半径突然明显增大。副族自上而下,有效核电荷增加不明显,因而原子半径基本不变。至于镧系元素从左至右,各元素的最后一个都填充在(n-2)层上,由于内层电子对外层电子的屏蔽较有效,因此有效核电荷增加很少,原子半径略有收缩(约1pm),但累计有14个元素导致镧系原子半径相近,加上电子构型相似,因而镧系15个元素(常还包括钇)化学性质相近。镧系元素原子半径的收缩(镧系收缩),又导致其后的元素与其相应上一周期的同族元素的原子半径非常接近,如Zr与Hf,Nb与Ta,Mo与W等,它们的化学性质也极相近,常以共生矿在地球共存,化学上分离它们具有一定难度。
(3)电离能与电负性
在化学反应中,各元素原子将得到或失去电子使自己的外层电子构型变成稳定的构型,其得失电子的能力可用电离能(I)与电负性(X)来描述。
电离能(I)指基态气态原子或离子失去一个电子形成其相应的气态离子所需最低能量。同一周期中,自左向右元素的失去第一个电子的第一电离能I1总体上由小变大,到稀有气体时达到最大值,但会出现有规律的曲折变化,这与电子处于充满或半充满时(s2,p3,p6,d5,…)的构型较为稳定有关,如I1(B)<I1(Be),I1(O)<I1(N)等。同一主族内自上而下元素的I1递减。
一个原子既有得电子能力又有失电子能力,当它处于指定分子中时究竟倾向于得电子还是失电子呢?为统一说明原子在分子中的行为,鲍林(L.Pauling)综合了原子得失电子的能力,提出了元素电负性的概念。电负性是元素的原子在分子中吸引成键电子的能力。鲍林比较了A与B两原子间的生成热和A—A,B—B的键能数据,且指定F的电负性X=4.0,从而依此得出了其他元素的电负性。电负性越大的元素的原子在分子中吸引成键电子能力越大。在周期表中总变化趋势是:同一周期元素,从左到右电负性加大,同一族元素,从上到下电负性递减。因此,周期表中的左下角元素电负性最小,右上角则最大,其余元素居中。电负性X的周期性变化如图2-7所示。

图2-7 元素电负性与原子序数的关系
(4)金属性
元素的金属性和非金属性是指其原子在化学反应中失去和得到电子的能力。自然,比较电负性X的数值可判断元素的这个属性。凡X越小,元素的金属性越强;X越大,非金属性越强。因此,周期表左下角与右上角元素分别是最活泼的金属与非金属。其分界限在B,Si,As,Te,At与A1,Ge,Sb,Po两条对角线元素上。此区域及其附近元素常成为半导体材料,这些元素有时称为半金属,它们的电负性约在2.0左右,在不同条件下或呈金属性或呈非金属性。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




