人们在长期的生产实践中发现,有些物质的溶液甚至在浓度很低时就能显著改变溶剂的表面性质,并使之适合于生产上的某种要求,如降低溶剂的表面张力或界面张力,提高润湿、洗涤、乳化及起泡性能等。日常生活中的肥皂就是这类物质中的一种。其最显著的特点是,加少量到水中就能将水的表面张力降低很多。随着科学技术的进步和生产的发展,人们对表面活性剂的性质和作用进行了深入研究,并给出其比较确切的定义:加入少量(在浓度很低的情况下)就能显著降低溶剂表面张力的物质,称为表面活性剂。
1.溶液的表面张力
纯液体中加入其他组分,变成溶液后其表面张力(比表面吉布斯自由能)会发生变化。有的溶质的加入会使溶液的表面张力升高,有的则下降。下面介绍常见水溶液浓度对表面张力的影响情况。
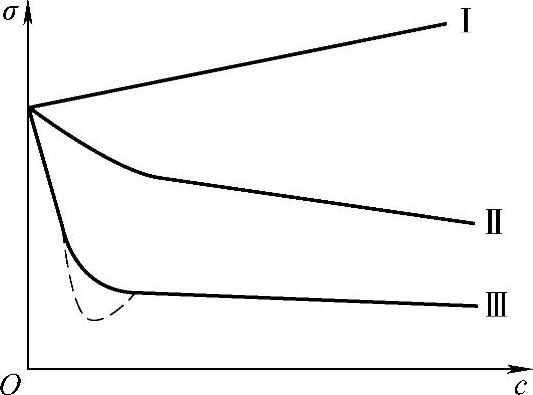
图3-1 水溶液表面张力与浓度的关系
恒温下,将各种不同浓度溶液的表面张力σ与对应的浓度c作图,得到的曲线称为溶液表面张力等温线。图3-1所示为常见的三种水溶液表面张力与浓度的关系。
第Ⅰ类曲线。这类曲线表示水溶液的表面张力随溶液浓度的增大而略有上升。这类溶液的溶质有无机盐、不挥发酸和碱等,以及含多个—OH的有机化物,如蔗糖等。由图3-1中的曲线Ⅰ可见,此类溶液的表面张力与溶液的浓度成线性关系。
无机盐类电解质之所以能提高水的表面张力,是因为无机电解质在水中电离成离子,带电粒子与极性水分子发生强烈的作用,使离子水化。实际上这类溶质加入后,溶液体相内部离子之间的相互作用比纯水的还要强,净吸力更大,所以表面张力增大。因而将溶液体相中的粒子移到表面更难,或者说这类溶质处于表面会使表面自由能更高。
第Ⅱ类曲线。如图3-1曲线Ⅱ所示,这类溶质的加入会使水的表面张力下降,随着浓度的增大,表面张力下降更多,但不是直线关系。属于这种类型的溶质有短链的有机脂肪酸、醇、醛、酯、胺及其衍生物等。
第Ⅲ类曲线。加入少量的溶质就能显著地降低水的表面张力。在很小的浓度范围内,溶液的表面张力急剧下降。然后σ-c曲线很快趋于水平,即再增大溶液的浓度,溶液的表面张力变化不大。有时水平线的转折处出现最小值,这是由于杂质的影响。属于这类物质的有肥皂、油酸钠、八碳以上直链有机酸及其碱金属盐、烷基苯磺酸钠、高级脂肪酸等。此类物质明显地表现出表面浓度大于溶液体相浓度,即产生正吸附。
2.表面活性物质与表面活性剂
常将能使溶剂表面张力降低的物质称为表面活性物质,如上述第Ⅱ类和第Ⅲ类物质均属于表面活性物质。其中在低浓度下就能显著降低溶剂表面张力的物质称为表面活性剂,也就是上述的第Ⅲ类物质。而那些使溶剂表面张力增大的物质则称为非表面活性物质,如上述第Ⅰ类物质。
实际应用时并不一定只有降低水表面张力的物质才是表面活性剂。例如:一些物质能改变液体对固体表面的润湿性能,能够使乳浊液稳定或破乳等;一些物质能改变液体对固体表面的张力。因此,目前认为凡是能够使体系的表面状态发生明显变化的物质,都可称为表面活性物质。
3.表面活性剂的结构特征
(1)表面活性剂的化学结构特征 以水的表面活性剂为例来说明表面活性剂的化学结构特征。表面活性物质之所以具有降低水表面张力的能力,是与它们的物质结构有关的。其共同的特征是两亲性:表面活性剂分子具有不对称性,同一个分子上含两亲基团(具有引起表面活性的化学基团的物质一般被称为两亲基团,表明它们对两个本质上不可混合的相具有某些亲和力)。一端为亲水基团(又称为憎油基团),如—COO-、—OH、—SO3H(磺酸基)等,它是极性基团,易溶于极性溶剂中;另一端为亲油基团(又称为憎水基团),它是非极性基团,一般为碳氢链。例如肥皂(硬脂酸钠C17H35COONa),其中C17H35—为亲油基团,—COONa为亲水基团,如图3-2所示。常以符号“O—”表示,其中“—”表示憎水部分,“O”表示亲水部分。洗衣粉(烷基苯磺酸钠)的亲水基团是磺酸钠(—SO3Na)。虽然表面活性剂分子的特点是两亲性,但并不是所有的两亲性分子都是表面活性剂,只有亲油部分有足够长度的两亲性物质才是表面活性剂。例如在脂肪酸钠盐系列中,碳原子数少的化合物(甲酸钠、乙酸钠、丙酸钠、丁酸钠等)虽皆具有亲油基团和亲水基团,有表面活性,但不起肥皂作用,故不能称之为表面活性剂。只有当碳原子数增加到一定程度后,脂肪酸钠才表现出明显的表面活性,具有一般的肥皂性质。大部分天然动物油脂都是含10~18个碳原子的脂肪酸酯类,这些物质如果结合一个亲水基团就会变成有一定亲油性、亲水性的表面活性剂,且有良好的溶解性。碳原子越多,洗涤作用越强,而起泡性却以12~14个碳原子最佳。如果碳原子数过多,则将成为不溶于水的物质,也就无表面活性了。
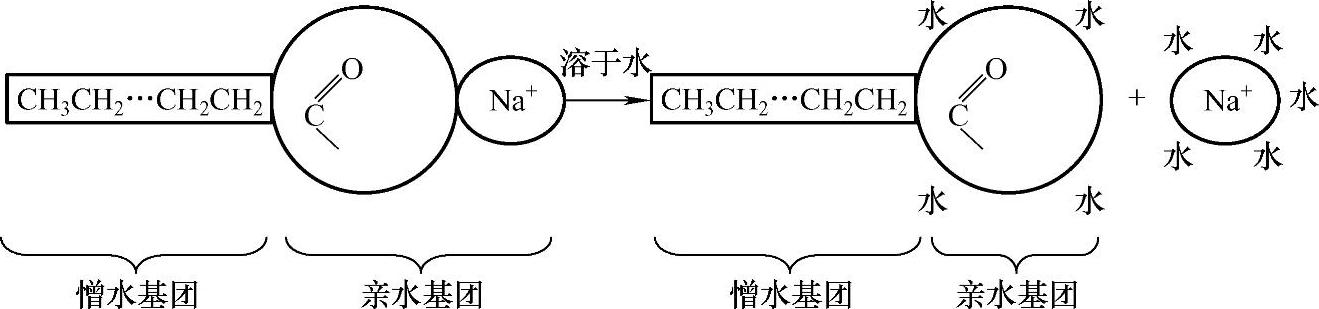
图3-2 肥皂的亲油基与亲水基
由于水是极性液体,因此表面活性剂溶于水后,其极性头与水的亲和力使其倾向于处于水中。而亲油的尾端又受到水的排斥,有逃离水的倾向。为了克服这种不稳定状态,就只有处于溶液的表面,将亲水基团伸入水中,憎水部分伸向空气(或油相)。于是,本体相内部水对处于表面层的表面活性物质分子的拉力比处在表面的水分子要小一些,表现在宏观上就是溶液的表面张力比纯水的小。表面活性剂分子的两亲结构不仅导致表面活性剂分子在界面上的吸附,随之改变相应的界面能,而且常导致吸附分子的优势取向,使得憎液基团脱离溶剂本体相而取向。
当表面活性物质溶解在溶剂(不论是水还是有机溶剂)中时,疏液基团的存在引起液体结构不利的畸变,增加了体系的总自由能。表面活性剂优先吸附在界面,或经过一些其他过程来降低体系的能量(如形成胶束)。如前所述,在将液体内部的分子搬到液体表面时,需要克服内部分子的吸引力而消耗功。因此,比表面吉布斯自由能σ可定义为增加单位面积所消耗的功,在数值上等于表面张力,即

相对于溶剂分子来说,将表面活性剂分子带到界面只需要较少的功,表面活性剂的存在减小了表面张力,降低了增大界面面积而需要的功。
除了要求具有以上的化学结构特征之外,还要求表面活性剂具有适当的溶解性质,而且其化学结构随着使用溶剂体系性质和使用条件的变化而变化。例如:在水中,当结合有适当的亲水基团时,憎水基团(“尾”)可以是足够长的碳氢链、碳氟链或硅氧烷链来产生所设计的溶解度特征。水的表面活性剂的亲水基团(“头”)是离子性或高极性的,所以它具有溶解功能。由于温度、压力或表面活性剂溶剂环境的变化,体系的溶液和界面性质可能发生重大变化,所以条件的变化将要求改进表面活性剂的化学结构,以便保持理想的表面活性。
(2)表面活性剂的亲水基团——增溶基团 从化学结构的分类中可以看到,现代表面活性剂的增溶基团一般分成两种:在水溶液中(或高极性溶剂中)离子化的和不离子化的。显然,分子中哪部分定义为增溶基团依赖于所应用的溶剂体系。例如,在水中,溶解度将由离子或高极性基团的存在来决定;相反,在有机体系中,活性基团(根据溶解度)将是有机基团。因此,在讨论表面活性剂类型前,重要的是要确定所考虑的整个体系。
仍然以水的表面活性剂为例,离子型亲水基团主要具有强酸或强碱的特征,当中和时,形成真正的高离子化的盐,如硫酸盐、磺酸盐等。
另一方面,单个非离子型亲水基团具有相对弱的亲水性,但具有可加和效应,所以在分子中通过增加它们的数目来增大它们的溶解效果。
(3)表面活性剂的憎水基团 迄今为止,表面活性剂中最常用的憎水基团是总数8~20个碳原子的烃基,这些材料既不贵又有足够量供应,主要有两个来源:生物来源,如农业和渔业,以及石油工业(当然根本的来源也是生物)。
常见表面活性剂的憎水基团有:
1)天然脂肪酸。主要由动物油、植物油中的甘油三酸酯水解来获得,这类物质中最有用的是12~18个碳原子的脂肪酸。天然脂肪酸中最常用的是饱和酸,一些不饱和酸也被使用,如油酸。因为大多数植物油包含高比例的不饱和脂肪酸,对于肥皂和洗涤剂产品,为了分离有用的异构体,它们常需要深加工。
2)烷烃。这些烃类物质从汽油和石油蒸馏获得。它们一般是具有10~20个碳原子的饱和烃。混合物通常包含支链同系物、一些环状物和芳香基团(苯、甲苯、萘等)。
3)烯烃。表面活性剂类别的烯烃通常是不饱和的,它们一般是具有10~20个碳原子的烯烃。
4)烷基苯。工业上用烯烃和苯的弗雷德-克兰弗茨(Friedel-Crafts)反应制得。
5)烷基芳香烃。这是一类以所谓多核芳香烃为基础的物质,如萘、蒽。在这类物质中,工业生产和使用的主要表面活性剂品种是烷基萘磺酸盐。
6)醇类。自然界存在着长链醇(它们一般具有8~18个碳原子),但是通常数量有限,在经济上限制了直接使用。但是,通过对脂肪酸或脂肪酸酯的催化还原,通过对乙烯或其他轻烯烃的共聚物的氧化,或通过α-烯烃的氧化,它们已能工业化生产。
7)聚氧丙烯。它是主链上含有非碳原子的憎水基团中最重要的类型。这类物质中最重要的成员可由氧化丙烯的碱催化反应制备。
8)碳氟化合物。碳氟化合物的制备主要在羧酸氟化物或磺酸氟化物的碳链上,通过电解氟化法取代氢来完成。虽然碳氟化合物表面活性剂较贵,但它们比碳氢类的具有更好的表面活性,使表面张力大大减小,并在恶劣环境下也不会严重降解。
9)硅酮。一般是结合有合适增溶基团的二甲基硅氧烷共聚物。虽然它们与烃类物质相比要贵些,但它们常在有机体系中显示出表面活性。
4.表面活性剂的分类
表面活性剂应用极其广泛,所以表面活性剂品种繁多。表面活性剂的分类有几种方法,可按溶解性分类、按相对分子质量分类、按用途分类,最常用的是按其分子的化学结构来分类,它是由溶解官能团的特性确定主要类型的。
(1)按化学结构分类 表面活性剂溶于水后,按离解或不离解分为离子型表面活性剂和非离子型表面活性剂。离子型表面活性剂又可按产生离子电荷的性质分为阴离子型、阳离子型和两性型表面活性剂,如下所示:
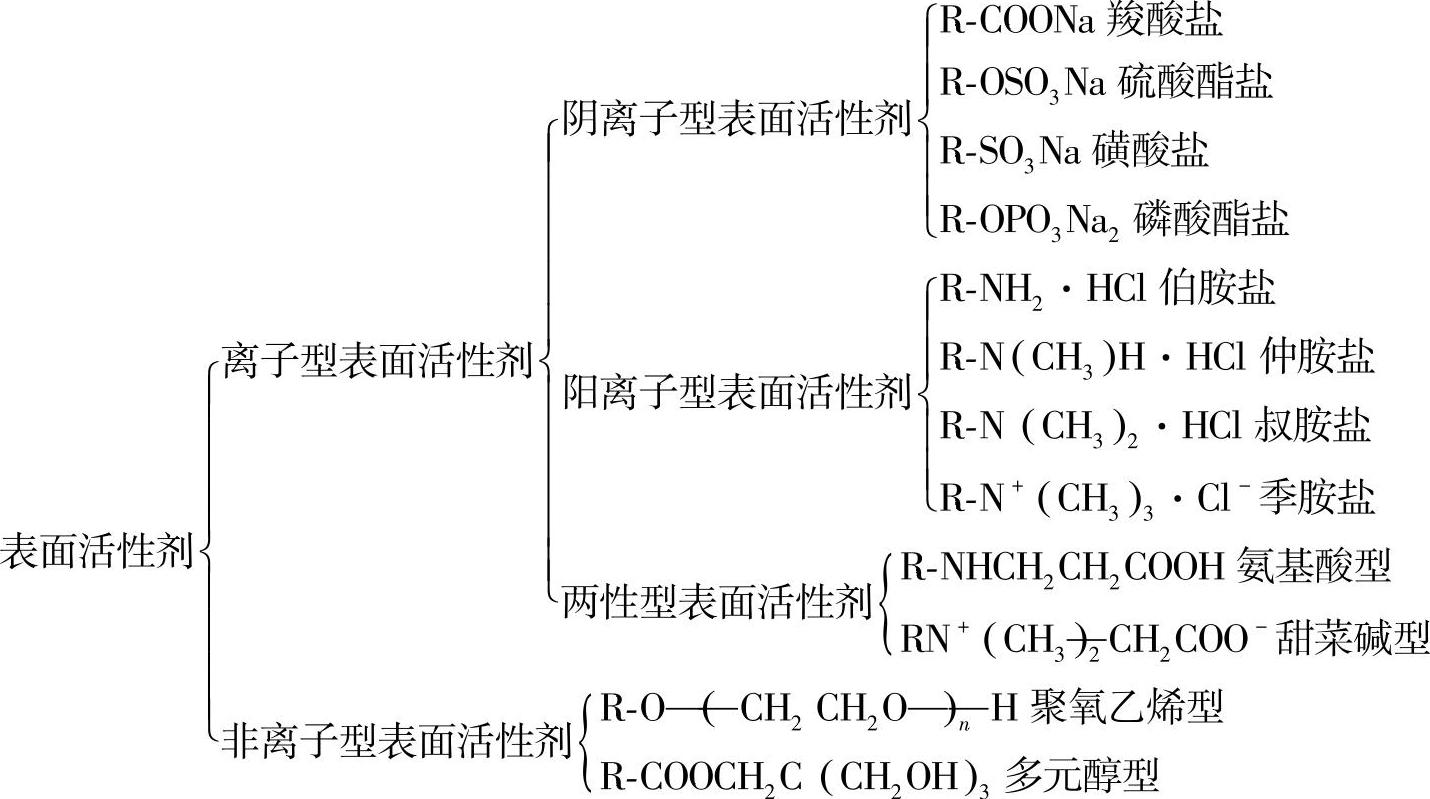
阴离子型:具有带一个负电荷的亲水基团,如羧酸盐、磺酸盐或硫酸盐。
阳离子型:具有带一个正电荷的亲水基团,如季胺卤化物。
两性型(或两性离子型):分子主链上具有或可以具有一个负电荷和一个正电荷(对应一个平衡反离子,M+或X-),如磺基甜菜碱。
非离子型:亲水基团没有电荷,但可从高极性基团获得水溶性,如聚氧乙烯、糖或类似基团。
(2)按溶解性分类 按在水中的溶解性,表面活性剂可分为水溶性表面活性剂和油溶性表面活性剂两类,前者占绝大多数。
(3)按相对分子质量分类 相对分子质量大于10000的称为高分子表面活性剂,相对分子质量为1000~10000的称为中分子表面活性剂,相对分子质量为100~1000的称为低分子表面活性剂。
常用的表面活性剂大都是低分子表面活性剂。中分子表面活性剂有聚醚型的,即聚氧丙烯与聚氧乙烯缩合的表面活性剂,在工业上占有特殊的地位。高分子表面活性剂的表面活性并不突出,但在乳化、增溶特别是分散或絮凝性能方面有独特之处,很有发展前途。
(4)按用途分类 表面活性剂按用途可分为表面张力降低剂、渗透剂、润湿剂、乳化剂、增溶剂、分散剂、絮凝剂、起泡剂、消泡剂、杀菌剂、抗静电剂、缓蚀剂、柔软剂、防水剂、织物整理剂、均染剂等。
5.表面活性剂的性质
(1)各种性质对浓度的转折点 表面活性剂的一个重要性质是能显著地降低溶液的表面张力。溶液的表面张力随表面活性剂浓度的增大而急剧下降,但浓度达到一定值(准确地说应是一个范围)后表面张力不再改变,且σ-c关系有一颇为明显的转折点。特别要注意的是,若表面活性剂中含有杂质,则在转折点附近将出现明显的最低点。很久以前人们就知道,皂类表面活性剂吸附溶液的性质与正常强电解质溶液相似,但高浓度时它们的性质却明显不同。例如,浓皂液的电导率与强电解质溶液有明显的差别,其他物理性质,如渗透压、蒸气压、密度、光学性质、去污能力及增溶作用等也有很大的差别,也都远比自理想溶液理论计算出的低。有意义的是,这些性质的突变总是发生在某一特定的浓度范围,即临界浓度。在某一狭窄的浓度范围内,一系列性质都出现一个转折点,这说明随着表面活性剂浓度的改变,不仅表面张力有突变点,而且其体相溶液性质也有突变,即溶液内部的状态发生了某种变化。
(2)表面活性剂的溶解度 在使用中,表面活性剂水溶性或油溶性(即所谓的亲水性和憎水性)的大小是合理选择表面活性剂的重要的依据。一般来说,表面活性剂的亲水性越强其在水中的溶解度越大,亲油性越强则越易溶于“油”,因此表面活性剂的亲水性、亲油性也可以用溶解度的性质来衡量。
离子型表面活性剂在低温时溶解度较低,随着温度的升高其溶解度缓慢增大,达到某一温度后其溶解度突然迅速增大,在溶解度-温度曲线上出现转折,这个温度称为Krafft点,用Tk表示。有机同系物的碳氢链越长,其Krafft点温度越高,因此,通过Krafft点可以衡量表面活性剂的亲水性、亲油性。
非离子型表面活性剂则不同。往往一个透明的非离子型表面活性剂水溶液在加热到一定温度时会突然变浑浊,这表示随着温度的升高溶解度下降。表面活性剂溶液呈现浑浊的最低温度称为浊点。非离子型表面活性剂通常是以羟基和醚键为亲水基团的,其亲水性主要靠亲水基团与水分子形成氢键来实现,但这种作用不很强,因此其亲水性一般不强,在升高温度或加入盐时减弱,从而使溶解度减小,甚至不溶于水,使得原来透明的溶液变浑浊,即成为乳浊液。因此,非离子型表面活性剂往往在其浊点以下溶于水,而在浊点以上不溶于水。在憎水基团相同时,亲水基团—CH2CH2O—越多,则亲水性越大,浊点越高;在亲水基团数相同时,憎水基团的链越长,则憎水性越大,浊点越低。因此可用浊点来大致判断非离子型表面活性剂的亲水性、亲油性。
6.表面活性剂的HLB值
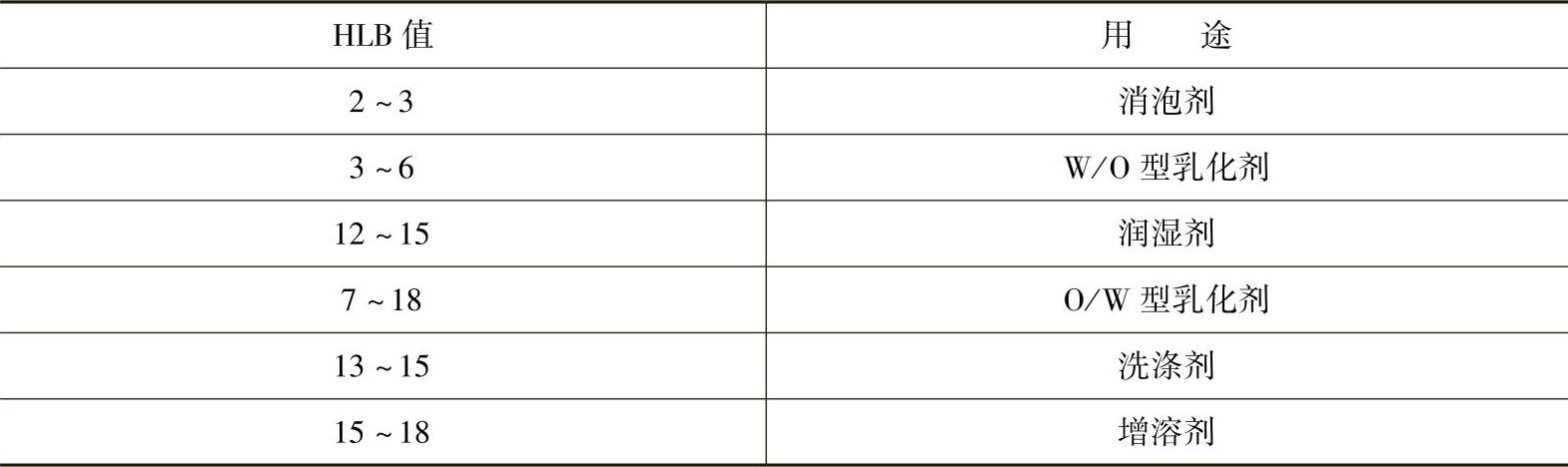
表面活性剂都是两亲分子,由于亲水基团和亲油基团不同,因此很难用相同的单位来衡量。每一种表面活性剂都有亲水基团的亲水能力和亲油基团的亲油能力,而且二者具有一定的平衡关系,这就是亲水亲油平衡。HLB(hydrophile and lipophile balance)值用于表示表面活性剂的亲水亲油平衡,是影响表面活性剂性能的重要参数。HLB的概念是由格里菲(Griffin)在1949年最先提出的,并规定最不亲水的石蜡HLB值=0,最亲水的十二烷基硫酸钠HLB值=40。其他各种表面活性剂的HLB值都处于0~40。显然,HLB值是相对的值,值越大,越亲水。HLB值很有实用价值,表3-18列举了HLB值的范围与用途,为实际应用的表面活性剂的选择提供参考。
表3-18 HLB值的范围与用途
(1)HLB值的估算方法
1)基数法。基数法是戴维斯(Davies)在1957年提出来的。此法将表面活性剂分解为一些基团,HLB值的计算公式为
HLB值=7+ΣH×亲水基团的HLB值–ΣL×亲油基团的HLB值
式中 H——亲水基团的基数;
L——亲油基团的基数。
这种方法适用于计算阴离子型和非离子型表面活性剂的HLB值,但对聚氧乙烯醚类的计算结果往往偏低。
【例】 计算十二烷基磺酸钠的HLB值,H(SO3Na)=11,L(—CH2—)=0.475。
HLB值=7+11-12×0.475=12.3(https://www.xing528.com)
2)质量分数法。此方法主要用于估算聚氧乙烯醚类非离子型表面活性剂的HLB值。其计算方法为
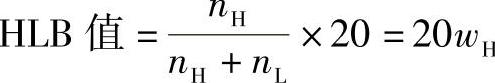
式中 nH——亲水基团的物质的量;
nL——亲油基团的物质的量;
wH——亲水基团的质量分数。
【例】 C18H37O(C2H4O)5H中亲水基团—O(C2H4O)5H的nH=237,而—C18H37的nL=253,故
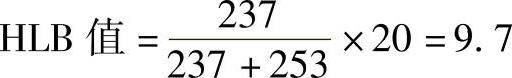
3)混合表面活性剂的HLB值。在实际应用中,使用的往往是几种表面活性剂的混合物(或复配物)。由于HLB值具有加和性,因此可以按其组成的各个表面活性剂的质量分数加以计算:
HLB值A,B=HLB值A·wA+HLB值B·wB
只要知道每种表面活性剂的HLB值,就可以计算复配物的HLB值。例如:吐温-80的HLB值为15,斯盘的HLB值为4.3。若按质量比7∶3混合,则复配物的HLB值为
15×0.7+4.3×0.3=11.79
(2)HLB值的测定HLB值也可由试验直接测定,其测定的方法有多种,下面简要介绍两种常用的方法。
1)分配系数法。将水和油(通常用辛烷)放在一起,再加入表面活性剂,当其在油水两相中达到溶解平衡后,分别测定它在两相中的浓度:水相中cW、油相cO。然后根据经验公式计算HLB值,即
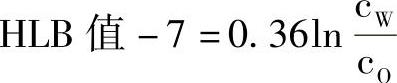
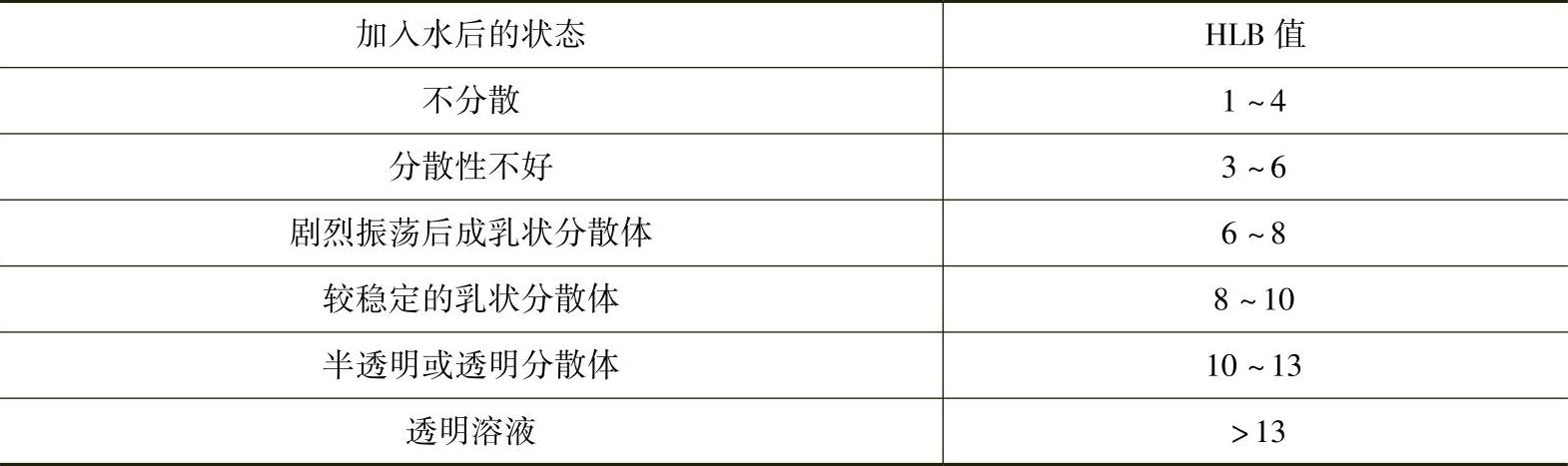
2)溶度估测法。在常温下将表面活性剂溶于水中,通过观察其在水中的分散状态可粗略估计其HLB值,见表3-19。此法的优点是简单、快速。
表3-19 表面活性剂在水中的分散状态与其HLB值
值得注意的是,HLB值只能作为表面活性剂选用时的参考,不是唯一的依据。
7.胶束
表面活性剂浓度大到一定程度后所出现的反常现象,是由于表面活性剂分子或离子自动缔合成胶体大小的质点引起的,这种胶体质点和离子之间处于平衡状态。因此,从热力学观点看,这种具有表面活性的缔合胶体溶液和一般胶体体系不同,是稳定体系。这种缔合的胶体质点就是胶束,它具有特殊的结构。
(1)胶束的形成 由表面活性剂的表面张力等温线可知,当表面活性剂浓度达到或超过某一值后,溶液的表面张力变化很小,σ-c曲线发生明显的转折。这个转折是与溶液达到饱和吸附相对应的。因为达到饱和吸附时,表面几乎全被表面活性剂所占据,溶液浓度再增大,表面活性剂不能再进入表面,所以溶液表面张力不再明显下降。于是表面活性剂在溶液内部另寻稳定的处境——形成胶束。
胶束又称为胶团,是在溶液内部,表面活性剂亲水的极性基团向着水,憎水的碳氢链聚集在一起形成憎水内核的有序组合体。由于胶束是表面活性剂通过缔合而成的,其大小达到了胶体分散体系的范围,所以这种溶液又称为缔合胶体或胶束溶液。
1)胶束的形成过程。胶束的形成过程如图3-3所示。当表面活性剂浓度很低时,它在表面上的浓度也很低,如图3-3a所示,水的表面张力变化不大。溶液浓度稍增大,表面活性剂就聚集到溶液表面,使水的表面张力大大降低,这时溶液内部的表面活性剂分子也会相互接触,把憎水基团挤靠在一起,称为小胶束,也称为预胶束,如图3-3b所示。再增大溶液的浓度,一直达到饱和吸附,表面活性剂会在溶液的表面上形成定向排列的单分子吸附膜,多余的分子在体相内部以憎水基团互相靠拢,聚集在一起形成胶束,开始形成胶束的最低浓度称为临界胶束浓度(critical micelle concentration),以CMC表示,如图3-3c所示,此时溶液的表面张力最小。当溶液的浓度达到或超过临界胶束浓度后,若再增大溶液的浓度,表面张力几乎不再下降,只是溶液胶束的数目和胶束的聚集数增加,如图3-3d所示。CMC越小,表面活性越大。通过物理化学性质的转折点可测定CMC。
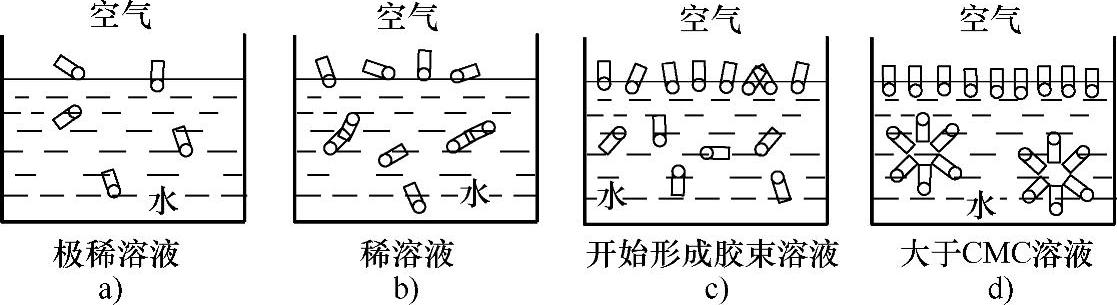
图3-3 胶束的形成过程
2)胶束自发形成的原因。胶束的自发形成原因是能量因素。众所周知,表面活性剂的碳氢链具有憎水性,与水分子的亲和力弱,因此碳氢链与水的界面能较高,憎水基团有逃离水的趋势。在溶液浓度不太高或CMC以下时,它们在溶液表面上浓集,形成单分子表面吸附层,将其亲油基团伸向空气;当溶液浓度达到或超过CMC时,表面吸附已达到饱和状态,如果溶液浓度仍继续增大,溶液内部的表面活性分子则采取另一种逃离方式,以使体系的能量达到最低(即达到另一种新的平衡状态),此时分子中长链的亲油基团通过分子间的吸引力相互缔合在一起,而亲水基团则朝向水中。这样,亲水基团将与水分子结合,亲油基团则自身相互抱成团,形成新平衡状态,于是表面活性剂在溶液内部形成缔合物即胶束,以减小界面自由能。
3)胶束理论对表面活性剂溶液性质的解释。当溶液浓度在CMC以下时,溶液中基本上是单个表面活性剂分子(或离子),表面吸附量随浓度增大而逐渐增加,直至表面上再也挤不下更多的分子,此时表面张力不再下降。也就是说,σ-c曲线上表面张力σ不再下降时的浓度可能正是开始形成胶束的浓度,这应该是各种性质开始与理想性质发生偏离时的浓度。浓度继续增大并超过CMC后,单个表面活性剂离子的浓度基本上不再增大,而胶束浓度或胶束数目增加。因为胶束表面是由许多亲水基团覆盖的,故胶束本身并不是表面活性的,因而不被溶液表面吸附。而胶束内部皆为碳氢链所组成的亲油基团,有溶解不溶于水的有机物的能力。胶束的形成使溶液中的质点(离子或分子)数目减少,因此依数性变化(如渗透压、凝固点降低)、电导率等性质变化减弱。
(2)胶束的结构、大小与形状
1)胶束的结构。胶束的基本结构包括两部分:内核和外层。在水溶液中,胶束内核由彼此缔合的憎水基团构成,形成非极性微区。在其内核与溶液之间是水化的表面活性剂极性基团外层。邻近极性基团的—CH2—基团,具有一定的极性,其周围存在着水分子,因为此时水分子有一定取向,因此又称为结构水,也称为渗透水。介于内核与极性头之间的—CH2—基团构成栅栏层。该层也可认为是胶束外壳的一部分。离子型和非离子型的胶束结构还有所不同。
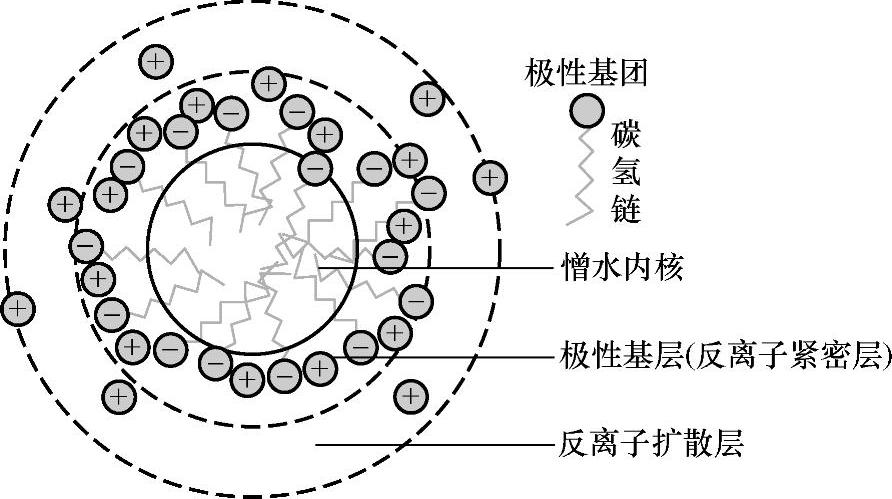
图3-4 离子型表面活性剂的胶束结构
离子型表面活性剂的胶束结构如图3-4所示,即哈特莱(Hart-ley)球状胶束,离子型胶束外层(壳)的反离子一部分与离子头基团结合,形成紧密层(或Stern层),还有一部分处于扩散层中,以保持胶束的电中性。非离子型表面活性剂的胶束结构与离子型不同的是,它没有双电层结构,其外壳由柔顺的聚氧乙烯链及醚键原子结合的水构成。
胶束的外壳不是光滑的面,而是不平的。这是由于胶束中的分子或离子与溶液中的单体在不停地进行交换,以及溶液中表面活性剂单体分子在进行热运动,这些均会使胶束外壳波动。
2)胶束的大小。胶束的大小一般是由聚集数来度量的。聚集数是缔合成一个胶束的表面活性剂分子的平均数,其数值可以从几十到几千甚至上万。聚集数的测定常用光散射法,其原理是用光散射法测出胶束的相对分子质量,或称为胶束量,再除以表面活性剂分子的相对分子质量,得到胶束的聚集数,即

因为胶束可能大小不一,测得的胶束量只是统计平均值,因而聚集数也是平均值。还可用扩散法、黏度法、超离心法测定聚集数。
影响胶束聚集数大小的因素有:表面活性剂同系物中,随憎水基团碳原子数增加,聚集数增加;非离子型表面活性剂憎水基团相同时,亲水的聚氧乙烯链长增加,聚集数减少;加入无机盐对非离子型表面活性剂的聚集数影响不大,而使离子型表面活性剂的胶束聚集数增加,其原因是电解质的反离子进入紧密层,压缩了扩散层,使胶束离子头基团电荷得到中和,电斥力减小,促使更多表面活性剂进入胶束;温度升高对离子型表面活性剂的胶束聚集数影响不大,只是略有减少,但对非离子型的影响显著,温度升高总是使其聚集数增加,特别是在接近其浊点时增加更快。
3)胶束的形状。胶束有不同的形状:球状、椭球状、扁球状、棒状、层状等,如图3-5所示。
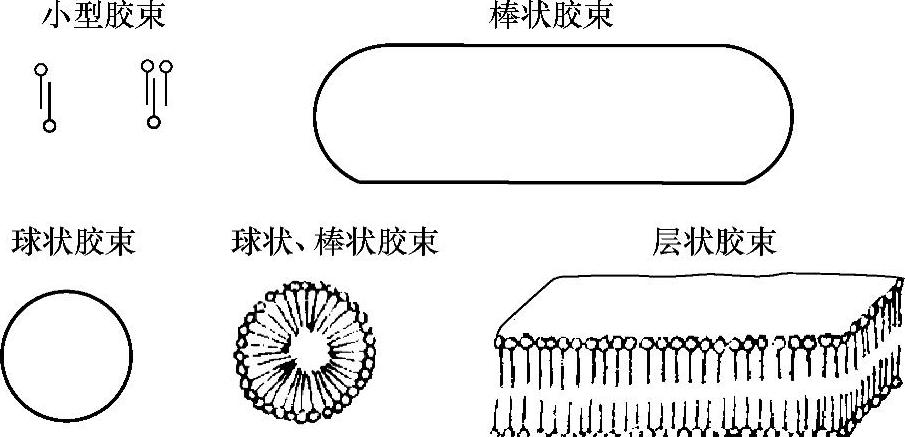
图3-5 胶束形状
光散射法研究表明,在超过临界胶束浓度(CMC)的一定浓度范围内,胶束是对称的球状,而且聚集数也不变。例如:C12H25SO4 Na水溶液在CMC时胶束的聚集数为73,随着浓度增大,聚集数保持不变。一般而言,只要超出CMC不大,没有其他添加物,则胶束大致呈球状。在高浓度或其他情况下,胶束的形状是不对称的,是扁球状、椭球状等。
在浓度为CMC10倍或更浓的溶液中,胶束一般是非球形的。德拜(Debye)根据光散射试验结果提出棒(肠)状胶束模型,如图3-6所示。这种模型使大量表面活性剂分子的碳氢链与水的接触面积缩小,有更高的热力学稳定性。这种棒(肠)状胶束有的还具有一定的柔顺性。
表面活性剂浓度更大时,棒状胶束聚集成六角胶束。若表面活性剂浓度再增大,则就会形成巨大的层状胶束。
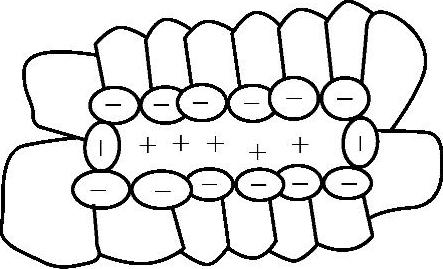
图3-6 反胶束示意图
4)反胶束。表面活性剂在非水介质中也会形成聚集体,其结构与水溶液中的胶束相反。它以亲水基团聚集在一起形成亲水的内核,而憎水基团构成外层,称为反胶束,如图3-6所示。
反胶束的聚集数比胶束的小,一般在10左右。反胶束的形成是水和亲水基团彼此结合或者形成氢键而结合的。在反胶束的形成过程中焓变起主要作用。反胶束的形状也没有胶束多,主要是球状。
5)高分子胶束。两亲性高分子表面活性剂与低分子表面活性剂一样,憎水基团在表面上吸附而使表面张力降低,同时在溶液内部缔合形成胶束。人们采用电镜证明了共聚物多分子胶束的生成。随后,又发现多分子胶束和临界胶束浓度的存在。胶束形成的推动力是憎水基团与水的相互作用,同时聚合物链的不相容性排斥力也起重要作用。通常认为,多分子胶束为球状,大小较均匀,球的中心为水不溶性核,外围是可溶性嵌段或接枝部分。由于高分子表面活性剂种类繁多,胶束的形状也有椭球状、棒状、蠕虫状等多种形状。
与低分子表面活性剂不同的是,在较低浓度下,高分子表面活性可能形成单分子胶束。憎水基团链段的不同溶解性以及相互的不相容性推动高分子表面活性剂在稀溶液中形成单分子胶束。
8.临界胶束浓度
临界胶束浓度是开始大量形成胶束时表面活性剂的浓度,以CMC表示。它是表面活性剂吸附效率的性能参数,每种表面活性剂在某温度下有其特定的CMC值。
影响表面活性剂临界胶束浓度的因素如下:
(1)表面活性剂结构的影响
1)憎水基团相同时,直链非离子型表面活性剂的CMC值比离子型表面活性剂约小两个数量级。
2)同系物中,无论是离子型还是非离子型,憎水基团的碳链越长,CMC值越小。
3)同系物中,无论是离子型还是非离子型,憎水基团的碳原子数目越多,CMC值越小。
4)憎水链中有双键时,其CMC值比具有相同碳原子数的饱和烃链的表面活性剂的CMC值大。
5)亲水基团和碳原子数相同时,憎水基团含有支链的CMC值大。
6)碳氟表面活性剂的CMC值比碳原子数相同的碳氢表面活性剂的小很多。
7)离子型表面活性剂在憎水基团相同时,CMC值相差不大。反离子不同,价态相同时,CMC值相差不大,但价态不同时,CMC值相差较大。
8)非离子型表面活性剂,如聚氧乙烯类,亲水基团中聚氧乙烯数目增多,会CMC值略有增大。
(2)电解质的影响 表面活性剂水溶液中加入电解质,对离子型表面活性剂的CMC值影响较大,尤其是与表面活性剂带相反电荷的离子及反离子的影响起决定作用,反离子的价态越高,影响越显著。其原因是:离子型表面活性剂胶束具有扩散双电层结构,当外加电解质时,会压缩扩散层,使更多的反离子与胶束的离子头结合,削弱了离子头间的电斥力作用,从而有利于胶束的形成。反离子的价态越高,降低CMC值的能力越强。同价反离子对CMC值影响的差别不大。
电解质对非离子型表面活性剂CMC值的影响,远不如对离子型的影响显著,只有在电解质浓度较高时才会观察到CMC值减小,而且影响的机理也不同。电解质大量加入时,由于电解质的溶剂化,使非离子型表面活性剂溶液的溶剂量相对减小,因此表现出CMC值减小。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




