1.氢的溶解
氢分子在高温下比氮容易分解为原子氢(见图6-1(a))。当热加工温度较高时,如处在焊接电弧温度(5 000~6 000K)环境中,氢分子几乎全部分解为原子氢。而当热加工温度较低时,如在普通的熔炼温度(熔炼炉中的温度为1 600~1 700℃)条件下,大部分氢还是处于分子状态。
氢能溶于所有金属。根据与氢的相互作用和吸氢规律的不同,金属可分为两大类:与氢不形成稳定化合物的第Ⅰ类金属及与氢能形成稳定化合物的第Ⅱ类金属。
(1)氢在第Ⅰ类金属中的溶解。第Ⅰ类金属包括Fe,Ni,Cu,Cr,Mo,Al,Mg和Sn等,所吸收的氢都溶解于金属。因此,这类金属所能吸氢的量或称“吸容氢”(即某温度条件下能被金属吸收的氢总含量)与其溶解度(即某温度条件下氢能在金属中形成溶液或形成固溶体的最大值)是一致的,且氢的溶解是吸热反应。
分子态的氢必须分解为原子态的氢或离子态的氢(主要是H+)才能溶解于金属中。在一般熔炼条件下,当气相中的氢以分子状态存在时,这类金属的吸氢规律服从一般双原子气体在金属中溶解的平方根定律,即ω[H]=![]() ,此时氢在金属中的溶解过程如图6-7(a)所示。在电弧焊条件下,因为弧柱温度高,弧柱气氛中存在大量的氢原子和离子,因此焊接熔池中液态金属的吸氢量不受平方根定律的控制,大大超过了一般熔炼时的吸氢量,其溶解过程以图6-7(b)的方式为主。从图6-3中可以看到氢在铁(含1%Mn)中的溶解度变化与氮基本类似。铁在凝固点时,氢的溶解度有突变,在随后的冷却过程中,发生点阵结构改变时,氢的溶解度还有跳跃式的变化,即在面心立方点阵的γ-Fe中,比在体心立方点阵的δ-Fe及α-Fe中,能溶解更多的氢。
,此时氢在金属中的溶解过程如图6-7(a)所示。在电弧焊条件下,因为弧柱温度高,弧柱气氛中存在大量的氢原子和离子,因此焊接熔池中液态金属的吸氢量不受平方根定律的控制,大大超过了一般熔炼时的吸氢量,其溶解过程以图6-7(b)的方式为主。从图6-3中可以看到氢在铁(含1%Mn)中的溶解度变化与氮基本类似。铁在凝固点时,氢的溶解度有突变,在随后的冷却过程中,发生点阵结构改变时,氢的溶解度还有跳跃式的变化,即在面心立方点阵的γ-Fe中,比在体心立方点阵的δ-Fe及α-Fe中,能溶解更多的氢。
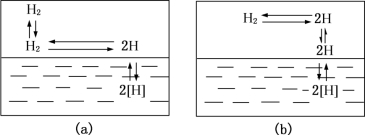
图6-7 氢在金属过程中的溶解示意图
(a)较低温度如熔炼时的溶解过程;(b)较高温度如电弧焊时的溶解过程
氢在这类金属中的溶解度随温度提高而增加(见图6-8、图6-9和图6-10)。因此,它们在加工过程中温度越高吸氢越多。另外,金属中的合金元素也会不同程度地影响氢的吸收量。Ti,Ta,Cr,C,Si等合金元素对铁中氢的溶解度影响如图6-11所示。
(2)氢在第Ⅱ类金属中的溶解。第Ⅱ类金属包括Ti,Zr,V,Nb和稀土等,它们的吸氢能力很强,其吸氢过程为放热反应。在温度不太高的固态下就能吸氢,首先与氢形成固溶体,当吸氢量超过了它的固溶度后就以氢化物析出。

图6-8 氢在第Ι类金属中的溶解度变化

图6-9 氢在铝和镁中的溶解度

图6-10 氢在铜、锡和铜锡合金中的溶解度

图6-11 合金元素对氢在铁中溶解度的影响(1 600℃)
因此,这类金属所能吸收氢的量超过了它的溶解度。但当温度超过了氢化物稳定的临界温度后(相应于图6-12上溶解曲线的拐点温度),氢化物分解为自由氢原子,并扩散外逸。所以,这类金属的吸氢量比第Ⅰ类金属的大得多,而且在加热到不太高温度的固态时就能吸氢。因此,在加工这类金属时要特别注意氢的污染。除了焊接和铸造这类金属及其合金时必须在真空或惰性气体保护下进行外,锻造加热时也要防止吸氢,如钛合金在加热、酸洗及模锻过程中与油等碳氢化合物接触时都可能产生吸氢现象。当合金中氢含量超过一定数量(0.015%)后,便会发生氢脆。
图6-12 氢在第II类金属中的溶解度变化
2.氢的有害作用
一般来说,氢的有害作用主要是导致脆化和形成气孔,体现在如下4个方面。
(1)氢脆。金属的氢脆一般可分为两类。
①第1类脆化是由氢化物引起的。例如,在钛及其合金中,当含氢量超过了它的溶解度后,在冷却过程中会由于溶解度降低而在金属中析出脆性的片状氢化物TiH2,成为脆断时的裂纹源。这类脆化的特点是其脆化程度随加载变形速度加大而增大,而且温度越低脆化越严重。
②第2类脆化是由于过饱和的氢原子在金属慢速变形时的扩散聚集及与位错的交互作用而引起的。其脆化机制为:在试件拉伸过程中,金属的位错发生运动和堆积,从而形成显微空腔;与此同时,溶解在晶格中的原子氢,不断沿位错运动方向扩散,最后聚集于显微空腔内,并形成分子氢,使空腔内产生很高的压力,加速微裂纹的扩展,而导致金属的变脆。它产生于一定的温度范围内和小的变形速度下。当温度较高时氢易扩散外逸;当温度很低时氢的活动能力太低,不易扩散聚集。一般低碳钢和低合金钢在室温附近时氢脆最明显,如图6-13所示。当加载速度很大(如冲击试验)时,位错运动的速度很大,而氢的扩散聚集来不及进行,因此不会出现脆化。与第一类脆化相反,其特点为脆化程度随加载变形速度加大而减小。

图6-13 氢含量对低碳钢塑性的影响
(2)白点。白点是指钢材内部氢脆引起的微裂纹,其纵向断口为表面光滑的圆形或椭圆形银白色斑点,故称为白点(俗称鱼眼)。白点的直径一般为零点几毫米到几毫米,或更大一些,其周围为塑性断口,故用肉眼即可辨识。许多情况下,白点的中心存在小尺寸的夹杂物或气孔。白点一般容易产生于具有珠光体、贝氏体及马氏体组织的中、大型截面的锻件中,尤其是存在于含Cr,Ni和Mo的材料如Cr-Ni,Cr-Ni-W,Cr-Ni-Mo钢以及含碳量高于0.4%~0.5%的碳钢中。
(3)氢气孔。一般情况下,在金属熔点温度,氢在金属中的溶解度有明显的突变,即液态金属吸收氢的能力大,而在固态金属中的溶解度明显小,如表6-6所示。由于合金通常是在一定的温度范围内熔化或凝固,而气体溶解度的突变也正是发生在液相线和固相线之间的温度范围内,因而当液态合金中含有饱和的氢时,在合金降温凝固过程中,因溶解度的突然降低而超过溶解饱和极限,就会有大量氢气析出。一旦合金表面已凝固,在其内部析出的氢就不能逸出,从而在工件内部形成气孔缺陷。例如,由表6-6可知,溶于铝液内的氢虽然少于溶于其他液态金属中的氢,但其在固态铝中的溶解度非常小,液相和固相中的溶解度相差悬殊,其(CL-CS)/CS=16.5。这就是铝及其合金铸造过程中容易出现氢气孔的主要原因。为防止合金过多吸氢,加工时合金不宜过热及长期保温。(https://www.xing528.com)
(4)冷裂纹。冷裂纹是金属冷却到较低温度下产生的一种裂纹,这种裂纹也是由于氢的扩散引起的,有时在工件运行过程中都有可能发生,危害性很大。
表6-6 熔点温度时氢在金属中的溶解度

3.氢的控制
(1)限制氢的来源。金属熔炼时,必须确保炉料干净、少锈和无油。对于严重生锈的废金属,使用前应进行喷砂除锈处理;潮湿的金属炉料入炉前需要预热;表面有油污的金属炉料必须经过预热或除去油污。对于造渣材料,要严格控制水分的含量,如要求石灰的含水量小于0.5%,并置于桶内封存,入炉前需进行预热。炉膛、出钢槽、浇包等均应充分干燥。
金属焊接时,须限制焊接材料中的水含量,如焊条、焊剂、药芯焊丝必须进行烘干处理,尤其是低氢型焊条,烘干后应立即使用或放在低温(100℃)烘箱内,以免重新吸潮。另外,还需要清除焊丝和焊件表面的杂质。当焊接铝和钛及其合金时,因常形成含水的氧化膜,焊接前必须用机械或化学方法进行清除。
(2)冶金处理。在金属熔炼过程中,常通过加入固态或气态除气剂进行除气,如将氯气通入铝液后,氯气与氢就能发生如下化学反应:

由上述反应可知(上述反应放热),铝液中的氢不仅可以氯化生成氯化氢气体,逸出铝液表面,还可以通过扩散作用,进入氯化铝气泡内,并通过AlCl3气体的逸出,达到良好的去氢效果。
在实际生产中,也可以采用通入混合气体的方法除气,如氮-氯混合气体或氯-氮-氧化碳(由其他反应生成)的混合气体等,以减少氯气对熔炼设备的腐蚀作用。
在焊接中,常通过调整焊接材料的成分,使氢在高温下生成比较稳定的不溶于液态金属的氢化物(如HF,OH)来降低焊缝中的氢含量,如在焊条药皮和焊剂中加入氟化物。氟化物的去氢机制有以下两种:
①在酸性熔渣中,渣中CaF2和SiO2同时存在时能发生如下化学反应:
![]()
上述反应生成的气体SiF4沸点很低(90℃),并与气相中的原子氢和水蒸气发生如下反应:

②在碱性药皮焊条中,CaF首先与药皮中的水玻璃发生如下反应:


与此同时,CaF与氢和水蒸气发生如下反应:

上述反应生成的NaF和KF又与HF发生如下反应:

生成的氟化氢钠和氟化氢钾进入焊接烟尘,从而达到了去氢的目的。
此外,适当增加熔池中的氧含量,或提高气相的氧化性,也可以减少熔池中氢的平衡浓度。因为气相中的氧可以夺取氢生成较稳定的OH,如:

上述反应结果使气相中的氢分压减小。有研究表明,熔池中氢的平衡浓度计算式如下:

由式(6-31)可知,气相中氢的分压减小或熔池中氧含量增加,都可以减小熔池中氢的浓度。另外,在药皮或焊芯中加入微量稀土元素钇或表面活性元素碲、硒,也可以大大降低焊缝中扩散氢的含量。
(3)控制工艺过程。铸造时,适当控制液态金属的保温时间、浇注方式、冷却速度;焊接时,调整焊接工艺参数,控制熔池存在时间和冷却速度等,均能减少金属中的氢含量。
(4)脱氢处理。焊后把焊件加热到一定温度,促使氢扩散外逸的工艺称为焊后脱氢处理。将焊件加热到350℃,保温1h,可使绝大部分的扩散氢去除。在实际生产中对易产生冷裂纹的焊件,常常要求进行焊后脱氢处理。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




