化学反应速率是表征爆炸/爆燃反应体系能量输出结构和做功能力的重要参数。对于活性毁伤材料而言,多组分体系化学反应速率快慢,在很大程度上决定着爆燃超压效应、热效应及其对目标毁伤能力的强弱。
1.化学平衡及平衡常数
化学反应通常发生在多相多组分系统中,使用热力学判据对反应过程的方向和限度进行判定时,需要用偏摩尔量进行相关计算,吉布斯函数的偏摩尔量即为化学势。对于任意化学反应![]() ,随着反应进行,各组分摩尔数均发生变化,系统吉布斯函数也随之变化,在恒定T,p,W′=0时,有
,随着反应进行,各组分摩尔数均发生变化,系统吉布斯函数也随之变化,在恒定T,p,W′=0时,有
式中,μB为化学势。将反应进度dξ=dnB/vB代入式(2.40),得到
式中,(∂G/∂ξ)T,p为一定温度、压力和组成条件下,反应进行了将dξ微量进度折合成每摩尔反应进度时所引起的系统吉布斯函数变化。
换种说法,可以看作无限大量反应系统进行了1 mol进度化学反应时所引起的系统吉布斯函数变化,即摩尔反应吉布斯函数,通常用ΔrGm表示。
根据恒温恒压条件下吉布斯函数判据,有:
若ΔrGm<0,(∂G/∂ξ)T,p<0,反应正向进行,反应物自发生成产物;
若ΔrGm>0,(∂G/∂ξ)T,p>0,反应不能自发正向进行;
若ΔrGm=0,(∂G/∂ξ)T,p=0,反应达到平衡。
恒温恒压下吉布斯函数值G随反应进度ξ的变化关系如图2.3所示。从图中可以看出,ξ随反应进行而增加;系统吉布斯函数G逐渐降低,降至最低时反应达到平衡。最低点左侧曲线斜率(∂G/∂ξ)T,p<0,表明反应自发正向进行;最低点处(∂G/∂ξ)T,p=0,系统达到化学平衡;最低点右侧曲线的斜率(∂G/∂ξ)T,p>0,表明若ξ进一步增加,G将增大,这不可能自发进行。如果系统开始处于最低点右侧,则反应逆向自发进行,逐渐从右侧向最低点趋近,至最低点时达到平衡,即吉布斯函数减小的自发过程。对于恒温、恒容系统,可用亥姆霍兹函数A代替吉布斯函数G进行类似分析。
图2.3 恒温恒压下G随ξ的变化关系
基于平衡条件化学反应方向分析,还可对化学反应平衡进行定量描述,平衡常数Kθ即为最常用的参量之一。平衡常数Kθ热力学定义为
式(2.42)定义表明,平衡常数Kθ除了与热力学函数Δr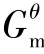 相关外,还与反应系统中的平衡组成有关,Δr
相关外,还与反应系统中的平衡组成有关,Δr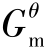 可通过三种方法来计算。
可通过三种方法来计算。
①通过化学反应Δr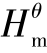 和Δr
和Δr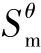 计算Δr
计算Δr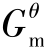 。
。
②通过Δf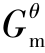 计算Δr
计算Δr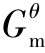 。
。
式中,Δf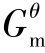 为标准摩尔生成吉布斯函数变化,单位为kJ·mol-1。
为标准摩尔生成吉布斯函数变化,单位为kJ·mol-1。
③通过相关反应计算。
如果一个反应由其他反应线性组合得到,那么该反应的Δr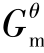 可由相应反应的Δr
可由相应反应的Δr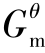 线性组合得到。
线性组合得到。
平衡组成测定必须是反应体系已处于平衡状态,可通过化学或物理方法来测定,如平衡时各组分的浓度、分压等。平衡组成的主要特点:一是在反应条件不变情况下,平衡组成应不随时间变化;二是一定温度下,由正向或逆向反应的平衡组成所算得Kθ应一致;三是改变原料配比所得Kθ应相同。
2.反应速率方程(https://www.xing528.com)
浓度和温度是影响化学反应速率最重要的因素,化学反应速率方程或反应动力学方程是描述反应速率与浓度、温度、时间之间的关系。在此先分析恒温下反应速率与浓度之间的关系,然后分析温度对反应速率的影响。
对于任意化学反应,定义反应物转化速率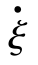 为
为
式中,ξ·为广度量,即单位时间反应进度,单位为mol·s-1。
定义单位体积转化速率为反应速率r,单位为mol·m-3·s-1,即
对于恒容反应,如密闭反应器中反应或液相反应,体积V为常数,即dnB/V=dcB,可用浓度cB代替dnB/V,式(2.46)可写为
对于某指定反应物A或产物Z,通常可用消耗或生成速率来表示。在恒容条件下,反应物A的消耗速率或产物Z的生成速率可表述为
另外,通过反应化学计量式,可以得到反应中某气体组分A的分压与体系总压之间的关系。反应物A基于浓度和分压的反应速率可分别表述为
式中,n为反应级数,对于任一特定反应是个定值;kA为浓度速率常数,单位为mol1-n·m3(n-1)·s-1;kp,A为分压速率常数,单位为Pa1-n·s-1。
对于恒温恒容理想气体A,将pA=cART代入式(2.49),得到
由此可见,在T,V一定时,气相反应速率既可用dcA/dt来表示,也可用dpA/dt来表示,特别是当反应级数n=1时,kA和kp,A相等。
对大多数化学反应而言,反应速率都随温度升高而增大。反应速率随温度变化主要体现为反应速率常数随温度的变化。实验表明,对于均相化学反应来说,反应温度每升高10 K,反应速率常数可增大2~4倍,即
式(2.51)称为范特霍夫规则,k(T)、k(T+10 K)分别为对应于温度T和T+10 K时的速率常数,两者比值定性描述了温度对反应速率的影响。
为描述温度对反应速率的影响,阿伦尼乌斯方程(Arrhenius)建立了反应速率常数k与温度T之间的关系,微分形式为
式中,Ea为活化能,单位为J·mol-1,温度变化不大时,可被视为常数。
阿伦尼乌斯方程表明,lnk随T的变化率与活化能Ea成正比。也就是说,活化能越高,反应速率对温度变化越敏感。对于同时存在若干个反应的系统,高温对活化能高的反应有利,低温对活化能低的反应有利。
积分形式的阿伦尼乌斯方程为
式中,A为指前因子,也称为表观频率因子,单位与k相同。
式(2.53)表明,lnk与1/T呈直线关系,如果对一系列(1/T,lnk)实验数据作图,通过直线斜率和截距,可求得相应的活化能Ea及指前因子A。
进一步实验研究表明,当温度变化范围过大时,lnk-1/T图有一定的弯曲,表明指前因子A与温度有关,修正经验关系为
式中,A,B为实验常数,B取值一般在0~4。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




