除热力学基本参量外,热力学第二定律描述了热力学过程的方向性,表明了一切自发过程都有方向性,且过程不可逆,常用熵来判断方向性。
1.熵与克劳修斯不等式
卡诺循环是热力学过程分析的基础,即任意一个可逆循环均可分割成无限多个小卡诺循环,每个小卡诺循环的可逆热温商之和均为0,表述为
式中,δQr为小卡诺循环中系统与温度为T热源所交换的可逆热。
式(2.19)表明,对于任意可逆循环,可逆热温商δQr/T沿封闭曲线的环积分为0。也就是说,其积分只取决于系统始态和终态,与过程途径无关。
克劳修斯将上述过程中的状态函数定义为熵(S),表述为
对于非体积功为零的微小可逆过程,由热力学第一定律,有
式(2.21)中右边变量U,p,V,T均为系统的状态函数,其值取决于系统状态,即任何绝热可逆过程熵变均为0,绝热可逆过程为等熵过程。
在熵定义式dS=δQr/T中,温度T总是为正值,对于可逆吸热过程,有δQr>0,故dS>0,即系统可逆吸热后熵增加。例如一定量纯物质从固态变为液态再变为气态(s→l→g)的可逆相变过程,整个过程中系统不断吸热,熵不断增加,即Sg>Sl>Ss。从系统无序度上看,气态无序度最大,分子可在整个空间自由运动;固体无序度最小,分子只能在平衡位置附近振动;液体无序度介于气态、固态之间。也就是说,系统无序度增加,熵也随之增加。
在微观物理意义上,熵可由统计热力学中玻尔兹曼熵定理给出,即
式中,k为玻尔兹曼常数;Ω为系统总微观状态数。式(2.22)表明,系统总微观状态数Ω越大,系统的混乱度越高,系统的熵也就越大。
卡诺定理指出,工作于T1,T2两个热源间的任意热机i与可逆热机r,可逆热机的效率总是大于或等于任意热机,可表述为
任意热机完成一微小循环后,热温商之和小于或等于零,且等号只在可逆时成立。将任意一个循环用无限多个微小循环代替,式(2.23)可表述为
假设某一不可逆循环,由不可逆途径a和可逆途径b组成。对于不可逆途径a,有
对于可逆途径b,有
式中,下标ir表示不可逆过程;δQr,δQir分别为途径a中由状态1到状态2过程所对应的可逆热和不可逆热。
结合熵定义式,可得到
式(2.27)即为克劳修斯不等式,其中等号只在可逆时成立,表明系统过程的方向可通过比较过程的热温商与熵差(可逆热温商)进行判断。若过程热温商小于熵差,过程不可逆;若过程热温商等于熵差,则过程可逆。
对于单纯发生pVT变化过程的系统,熵变可根据熵定义式,即(https://www.xing528.com)
对于理想气体或凝聚态物质,若过程绝热(δQ=0),则有
式(2.29)表明,对于绝热过程,熵不可能减小,即熵增原理。一般情况下,系统与环境间往往并不绝热,这时可将系统与环境组成的隔热系统作为一个整体来考虑,该整体显然满足绝热条件,可表述为
式(2.30)即为熵增原理的另一种表述,表明隔离系统熵不可能减小。
不可逆过程可以是自发过程,也可以是依托环境做功的非自发过程。对隔离系统而言,若内部发生不可逆过程,则一定是自发过程,不可逆过程的方向即自发过程的方向。可逆过程属始终处于平衡状态的过程,可表述为
式(2.31)称为熵判据,即通过定量计算系统及环境的熵变,可判断反应过程的方向及限度。系统熵变计算分单纯pVT变化、相变及化学变化三种情况。通常情况下,化学变化过程和反应热都是不可逆的,反应热与反应温度之比并不等于反应熵变。物质标准摩尔熵的确立,使化学熵变计算成为可能。
基于热力学第三定律对熵基准,可以算出某一状态(T,p)下一定量物质的熵,即规定熵或第三定律熵。在温度为T的标准态下,1 mol物质的规定熵即为温度T时的标准摩尔熵,记作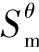 (T)。基于标准摩尔熵,即可算得化学变化过程的熵变,判定反应过程的方向及限度。
(T)。基于标准摩尔熵,即可算得化学变化过程的熵变,判定反应过程的方向及限度。
2.亥姆霍兹函数与吉布斯函数
克劳修斯不等式熵判据应用于隔离系统,需要同时计算系统熵变与环境熵变。在恒温恒容或恒温恒压情况下,利用热力学参量关系可对克劳修斯不等式进行简化,得到更简便的形式,即亥姆霍兹函数和吉布斯函数。
对于恒温恒容且非体积功为零的过程,即δQV=dU,将其代入克劳修斯不等式并进行微分,得到
式中,函数A为亥姆霍兹(Helmholtz)函数。因U,T,S均为状态函数,亥姆霍兹函数A也是状态函数,且为广度量,单位为J或kJ。
将式(2.33)代入式(2.32)中,对于微小过程,可表述为
对于宏观过程,可表述为
式(2.34)和式(2.35)即为亥姆霍兹函数判据,表明在恒温恒容且非体积功为零的条件下,对于一切可能的自发过程,亥姆霍兹函数减小;对于平衡过程,亥姆霍兹函数不变。与熵判据相比,亥姆霍兹函数判据无需考虑环境变化,仅由系统状态函数增量ΔA,即可判定反应过程的方向及限度。
对于恒温恒压且非体积功为零过程,即δQp=dH,将其代入克劳修斯不等式并进行微分,得到
式中,函数G即为吉布斯(Gibbs)函数。吉布斯函数G与亥姆霍兹函数A一样,也是一个广度状态函数,单位为J或kJ。
将式(2.37)代入式(2.36)中,对于微小过程,可表述为
对于宏观过程,可表述为
式(2.38)和式(2.39)即吉布斯函数判据,表明在恒温恒压且非体积功为零的条件下,对于一切可能的自发过程,吉布斯函数减小;对于平衡过程,吉布斯函数不变。吉布斯函数判据应用非常广泛,一是许多相变、化学变化均属恒温恒压且非体积功为零过程,二是也无需考虑环境变化,仅依据系统状态函数增量ΔG,即可对反应过程的方向及限度进行判断。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




