将式(4-14)
应用于孤立系统,因 Q=0,可得
Q=0,可得
式中,dSiso为孤立系统熵的变化量。式(4-19)说明,在孤立系统中,如进行的过程是可逆过程,其熵保持不变;如为不可逆过程,其熵增加;不论进行什么过程,其熵不可能减少。这就是孤立系统熵增原理,或简称熵增原理。熵增原理也是热力学第二定律的一种表述。因此,热力学第二定律也可称为熵定律,式(4-19)可作为热力学第二定律的数学表述。
值得指出,不论进行什么过程,孤立系统中的个别物体(子系统)的熵可以增加,也可以减少或不变,但孤立系统总体熵是永远不会减少的。
由孤立系统熵增原理可得出下列重要推论:
1.因为孤立系统的熵增加量是由过程的不可逆因素产生出来的,所以熵增加量(即熵产)可作为过程不可逆性的度量。
2.根据孤立系统的熵变化可判断过程进行的方向:如ΔSiso>0,为不可逆过程,这是实际可以进行的过程;ΔSiso=0,为可逆过程,这是理想极限情况;ΔSiso<0,这是不可能实现的过程。
3.由熵增原理,可得孤立系统的平衡条件为
这是因为由有限物体组成的孤立系统内不可逆过程得以进行,是其内部的压力差、温度差等不平衡“势”的驱使。随着不可逆过程的进行,孤立系统的熵不断增加,而这种势差却不断减少。达到平衡时,势差消失了,熵增的原因也消失,孤立系统的熵便达到最大值。
例4-4 如图4-10所示,量热器中有2kg、20℃的水和0.5kg、500℃的铁块,它们的比热容分别为 =4.186kJ/(kg·K)和
=4.186kJ/(kg·K)和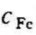 =0.4605kJ/(kg·K)。试按熵增原理论证当量热器中的水和铁的总熵达到最大值时,水温和铁块的温度相等,并求出此平衡温度(略去量热器的热容量和向环境的散热)及这一过程中水和铁块的总熵变化量。
=0.4605kJ/(kg·K)。试按熵增原理论证当量热器中的水和铁的总熵达到最大值时,水温和铁块的温度相等,并求出此平衡温度(略去量热器的热容量和向环境的散热)及这一过程中水和铁块的总熵变化量。
图4-10 例4-4用图
解 按题意,取量热器内的水和铁块为孤立系统。设不可逆热交换过程中水和铁块的瞬时温度分别为 和
和 。
。
按热力学第一定律
式中
所以
按熵增原理,系统达到平衡时,Siso→max,即
对水和铁块的热交换分别设想两个可逆过程,则水和铁块微元熵变分别为
将式(c)和(d)代入(b),可得
将式(a)代入式(e),可得
可见孤立系统总熵达到极大值时,水和铁块温度相等,即系统处于热平衡,此时系统的温度为平衡温度T。
对式(a)进行积分
于是可得
式中, 和
和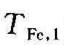 分别为水和铁块的初温。此式即为常用的热平衡方程。可见,这一简单的热平衡方程也是热力学第一定律和第二定律的综合结果,而决不是仅仅由热力学第一定律就能建立的。由上式,可得平衡温度为
分别为水和铁块的初温。此式即为常用的热平衡方程。可见,这一简单的热平衡方程也是热力学第一定律和第二定律的综合结果,而决不是仅仅由热力学第一定律就能建立的。由上式,可得平衡温度为
或
对式(c)和式(d)进行积分,可求得这一过程中水和铁块的熵变化量为
孤立系统(水和铁块)总熵的变化量为
复习思考题
1.热力学第二定律可否表述为:功可以完全变为热,但热不能完全变为功,为什么?
2.“循环功越大,则热效率越高”;“可逆循环热效率都相等”;“不可逆循环效率一定小于可逆循环效率”;“自发过程是不可逆过程,则非自发过程就是可逆过程”。这些结论是否正确?为什么?
3.自然界中一切过程都是不可逆过程,那么研究可逆过程又有什么意义呢?
4.下列说法是否正确,为什么?
(1)熵增大的过程为不可逆过程;
(2)不可逆过程ΔS无法计算;
(3)若从某一初态经可逆与不可逆两条途径到达同一终态,则不可逆途径的ΔS必大于可逆途径的ΔS;
(4)工质经不可逆循环,ΔS>0;
(5)工质经不可逆循环,由于 ,所以
,所以 ;
;
(6)可逆绝热过程为定熵过程,定熵过程就是可逆绝热过程;
(7)自然界的过程都朝着熵增大的方向进行,因此熵减过程不可能实现;
(8)加热过程,熵一定增大;放热过程,熵一定减小。
5.某封闭系统经历了一不可逆过程,系统从外界吸热为20kJ,同时对外界作膨胀功为10 kJ。(https://www.xing528.com)
(1)按热力学第一定律计算系统热力学能的变化量;
(2)按热力学第二定律判断系统熵的变化(为正、为负)。
6.某封闭系统经历了一不可逆过程,系统向外界放热为10kJ,同时外界对系统作功为20 kJ。
(1)按热力学第一定律计算系统热力学能的变化量;
(2)按热力学第二定律判断系统熵的变化(为正、为负、可正可负亦可为零)。
7.p-υ图和T-s图的重要性各何在?不可逆过程在这两个图上怎样表示?
8.某封闭系统经历了由几个简单的可逆过程(如定温、绝热、定压和定容)连结而成的复杂变化过程,如只知道这一复杂过程终态的熵大于初态的熵,就能确定该过程中系统从外界吸热吗?同样,如只知道这一复杂过程终态的比体积大于初态的比体积,就能确定该过程中系统对外界作膨胀功吗(提示:分别运用T-s图和p-υ图说明)?
习题
1.设工质在某热机循环中从高温热源吸热500kJ,向低温热源放热300kJ,试求循环热效率和工质对外作的净功。
2.设工质在某制冷循环中向高温热源放热1000kJ,消耗外界的机械功为200kJ,试求工质从低温热源吸收的热量和制冷系数。
3.设一可逆卡诺热机中工作于1600℃和300℃的两个热源之间,工质从高温热源吸热400kJ,试求:(1)循环热效率;(2)工质对外作的净功;(3)工质向低温热源放出的热量。
4.设一可逆卡诺热机中工质向温度为500℃的低温热源放出的热量为200kJ,热效率为50%,试求:(1)工质从高温热源吸收的热量以及高温热源的温度;(2)工质对外作的净功。
5.设一逆向可逆卡诺循环中工质从﹣10℃的低温热源吸收的热量为800kJ,制冷系数为8.5,试求:(1)工质向高温热源放出的热量以及高温热源的温度;(2)外界对工质作的净功。
6.有一半导体制冷装置,需用端电压E=24V、电流Ⅰ=30A的电功率,每小时可从这一装置的小冰箱中吸热2680kJ,求该装置的制冷系数ε和它的热接点向大气每小时的散热量?
7.热泵循环中传给高温热源的热量q1与所消耗的净功w(q1与w均取绝对值)之比称为供热系数εh,即
试推导卡诺热泵循环的εc.h公式。
8.试论证如违反热力学第二定律的克劳修斯说法,则必然违反开尔文说法。
9.试用热力学第二定律证明,p-υ图上任意两条可逆绝热线不能相交。
10.有A,B两物体,其初温TA>TB,两物体的质量相等m A=m B=m,其比热容亦相等CA=CB=C,且为常数。可逆热机在其间工作,从A吸热,向B放热,直至两物体温度相等时为止。
(1)试证明平衡时的温度为
(2)求出可逆热机对外输出的净功。
11.有A,B两可逆热机,它们的循环分别如图4-11(a)和(b)所示。
(1)试证明ηA/B=1+TL/TH;
(2)如TH=800K,TL=300K时,求出两可逆热机的热效率各为多少。
12.某热机循环中,工质先从T′H=600K的第一热源吸收热量Q′1,再从T″H=800K的第二热源吸收热量Q″1,向TL=300K的冷源放出热量Q1,循环净功为W。在下列条件下,试分别判断该热机循环是可逆的、不可逆的或不可能实现的:
(1)Q′1=1200J,Q″1=400J,W=800J;
(2)Q′1=1200J,Q″1=400J,Q2=750J;
(3)Q″1=400J,Q2=750J,W=900J。
13.如图4-12所示,用热机E带动热泵P工作,热机在热源T1和冷源T0之间工作,而热泵则在冷源T0和另一热源T′1之间工作。已知T1=1000K、T′1=310K、T0=250K。如热机从热源T1吸收热量Q1=1kJ,而热泵向另一热源T′1放出的热量QH供冬天室内取暖用。
(1)如热机的热效率为ηt=0.50,热泵的供热系数εh=4,求QH;
(2)如热机和热泵均按可逆循环工作,求QH
(3)如上述两次计算结果均为QH>Q1,表示冷源T0中有一部分热量传入了温度T′1的热源,而又不消耗(除热机E所提供的功之外的)其他机械功,这是否违反热力学第二定律的克劳修斯说法?
14.按习题4-10给定条件,如将A,B两物体在与外界绝热的条件下直接接触而进行热传递,直至两物体温度相等时为止。
(1)试证明此时的平衡温度
(2)试求这一不可逆热传递过程的熵产及作功能力的损失(环境温度为T0)。
图4-11 习题11用图
图4-12 习题13用图
15.为了帮助理解式(4-19)是热力学第二定律数学表达式,试用孤立系统熵增原理论证:(1)热力学第二定律的克劳修斯说法;(2)热力学第二定律的开尔文说法;(3)卡诺定理。
16.试用孤立系统熵增原理,对习题13的第三个问题作出确切的分析。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




