钢在高温炉内加热时,由于炉气中含有大量的O2、CO2、H2O,钢的表面层要发生氧化。钢材每加热一次,就有0.5%~3%的钢由于氧化而烧损。随着氧化的进行及氧化皮的产生造成了大量的金属消耗,增加了生产成本。
氧化不仅造成钢的直接损失,而且氧化后产生的氧化皮堆积在炉底上,不仅使耐火材料受到侵蚀,影响炉体寿命,而且清除这些氧化皮是一项很繁重的劳动,严重的时候加热炉会被迫停产。
氧化皮还会使钢件表面产生麻点,损害表面质量。氧化皮的热导率比纯金属低,所以钢件表面覆盖了氧化皮后又恶化了传热条件,导致炉子产量降低、燃料消耗增加。
1.钢的氧化层组织结构
(1)铁-氧平衡图与氧化层结构 氧在铁中的溶解度很低,汤根斯(Tankins)等人测定了体心立方铁中氧的溶解度为
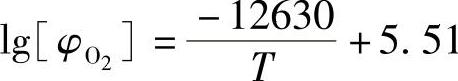
在常温下α-Fe的溶氧量(质量分数)小于0.05%,在950℃时溶氧量约为0.2%,可形成含氧的固溶体θ(含氧的奥氏体Oxyaustenite和含氧的铁素体Oxyfer-rite),它比纯铁具有更正的化学电位。
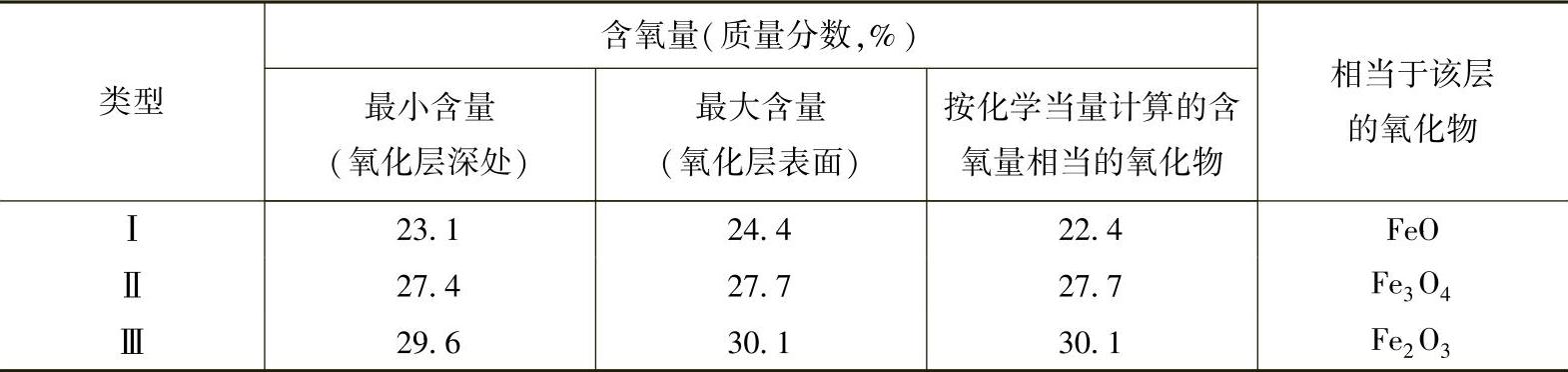
图10-11所示为铁-氧相图。氧与铁可以形成不同结构的氧化膜组成相,由图10-11中可以看出,随着含氧量不同分别形成FeO(FexO)、Fe3O4、Fe2O3。这些氧化物相的含氧量见表10-5,它们在铁表面的分布及各相结构如图10-12所示。
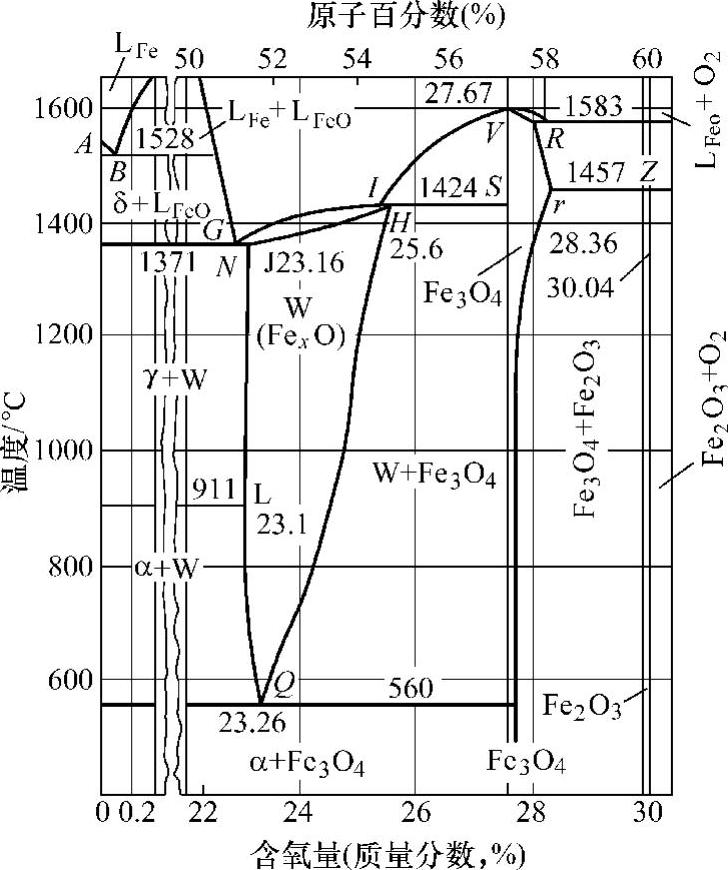
图10-11 铁-氧平衡状态图
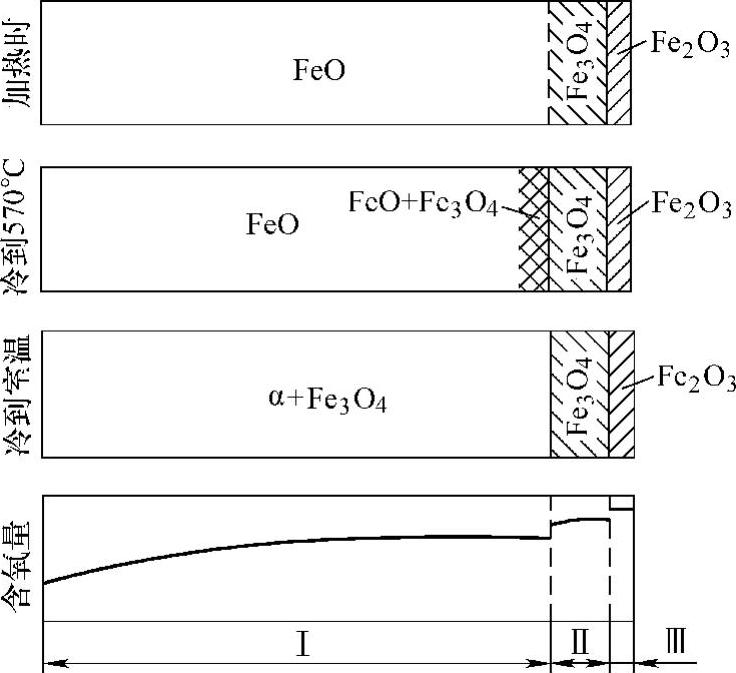
图10-12 氧浓度在铁表面的分布及各相结构
表10-5 不同氧化物相的成分
FeO是具有岩盐型立方点阵的缺位固溶体,过剩的氧在FeO中以氧离子形态存在于晶格中,并占据晶格的阴离子结点位置。由于氧在FeO固溶体中有一个固溶范围,如在1000℃时Fe∶O=1∶1.05~1.14,相当于Fe0.95O~Fe0.88O(含氧原子的百分数为51.2%~53.3%),所以也可写成FexO的通用形式。
高温氧化皮中的FeO是介稳状态,低温下它将发生以下分解
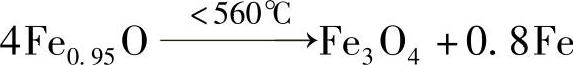
Fe3O4又称为磁性氧化铁,具有尖晶石型点阵,它从室温到1583℃都是稳定的,在氧化性介质中加热时将失去磁性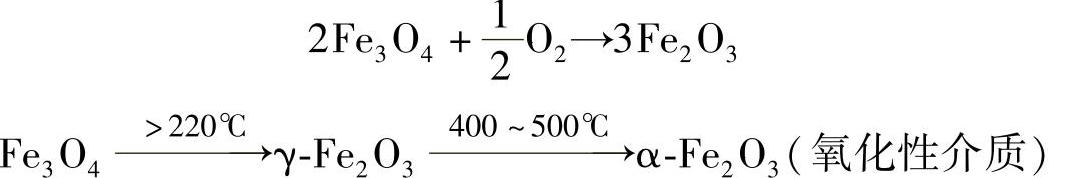
α-Fe2O3是斜方六面晶系,其基本晶胞由四个Fe3+与六个O2-结合而成。
氧化膜的结构如图10-13所示。对氧化膜的结构分析表明,与基体金属相连的第一层氧化物(图10-13中的区域4)遵循晶体点阵定向适应的规律,通常由立方晶系的Fe3O4、γ-Fe2O3或FeO组成,而不是斜方六面晶系的α-Fe2O3。初始形成的亚稳晶膜厚度极小,从单分子吸附层到几个定向氧化物晶胞,约为10nm。随着氧化膜增厚,氧化物晶格中累积的弹性应力使膜与基底的定向适应关系破坏,首先从膜的外层容易发生弹性应力释放,同时在氧化膜内晶体发生再结晶。第一层氧化物由厚度约十几个到几百个的晶胞所组成,在该层的外边形成的氧化膜是可见的主要区域,如果氧化物的体积比基体金属大时,则在氧化膜中存在着残余压应力。
在高温下氧化时发生的气相反应及应力的积累经常使氧化皮下产生凸起的小泡,而使应力部分释放。在这种情况下,特别是在氧化膜强度高而与金属表面的附着力又很弱时容易出现,并经常使氧化膜发生破裂以至剥落。
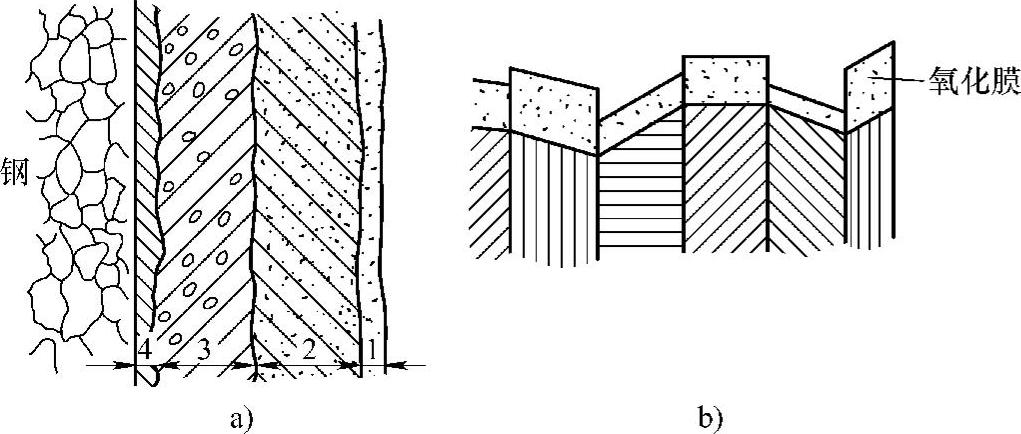
图10-13 氧化膜结构
a)铁的氧化膜结构 b)多晶体表面开始形成的亚稳晶膜
1—Fe2O3 2—Fe3O4 3—FeO+Fe3O4 4—FeO
(2)氧化膜的形成机理 氧化膜的形成过程比较复杂,因为开始形成氧化膜时就将介质和金属基体分隔开来,进一步氧化必须通过这个氧化物层。显然,氧化过程是由金属、金属氧化物和氧这三者之间的相互作用以及氧的扩散所控制的。在大多数情况下,离子或电子迁移速率控制着氧化速率,但有时界面反应也是控制氧化速率的决定因素。图10-14所示为氧以负离子状态被吸附在氧化层表面上,而金属以正离子状态溶解在氧化膜中。所以,氧化过程的驱动力是浓度梯度和氧化层中的电场,其中电场是由于在边界上的电子与离子运动速度不一样,从而形成双电荷层而产生的。
铁的氧化机理可以通过离子-电子在界面上的迁移过程来说明(图10-15)。
1)在界面Ⅰ上的铁原子形成Fe2+与2e-,并向FeO层中扩散,同时使界面Ⅰ向基体铁的一侧迁移。
2)在界面Ⅱ上,FeO层中的Fe2+与来自Fe3O4层中的O2-生成FeO晶格,与此同时,一部分Fe2+从界面Ⅱ向Fe3O4方向扩散。
3)在界面Ⅲ的Fe3O4一侧,按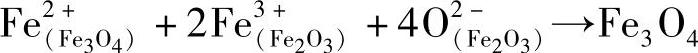 ,反应形成Fe3O4。此外,在界面Ⅲ的Fe2O3一侧,按
,反应形成Fe3O4。此外,在界面Ⅲ的Fe2O3一侧,按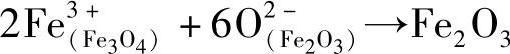 ,反应形成Fe2O3。(https://www.xing528.com)
,反应形成Fe2O3。(https://www.xing528.com)
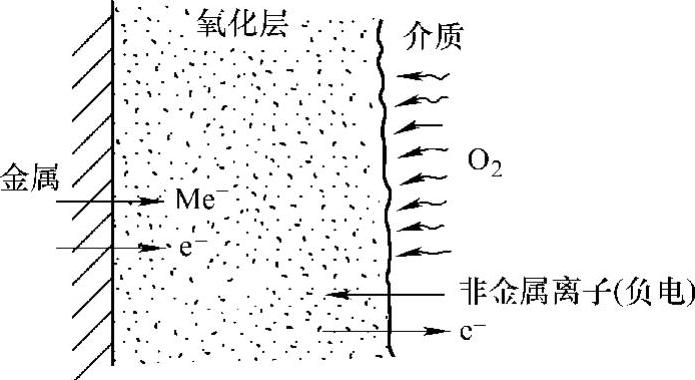
图10-14 金属表面与氧化介质间的作用
4)在最表层Ⅳ上,O2吸附在Fe2O3表层,在Fe2O3层中O2-向界面Ⅲ方向移动。由于形成速度慢,Fe2O3层很薄。
在高温下氧化时,由于氧化层中的压应力及CO2气体反应使氧化层发生龟裂及剥落,O2沿缝隙迅速侵入金属内层使氧化速度急剧上升。
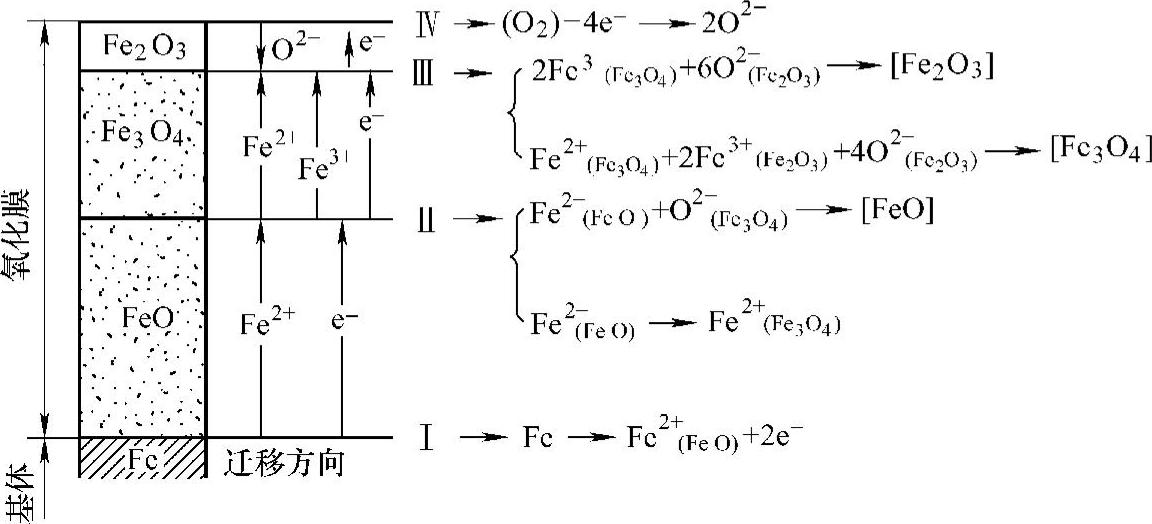
图10-15 铁的表面氧化机理示意图
2.形成氧化膜的影响因素
氧化膜的形成速度主要与介质成分、加热温度、保温时间及钢材的成分等因素有关[1]。
(1)钢材成分的影响 图10-16所示为碳钢含碳量与氧化速度的关系。当wC<0.40%时,氧化速度随着含碳量的增长而升高;当wC>0.40%时,氧化速度随着含碳量的增加而减小。
合金元素对氧化速度有很大影响,加入铬、铝、硅等元素可以形成致密的尖晶石型氧化物(Cr2O3、Al2O3、SiO2),这种氧化物结构对离子扩散具有强烈的阻止作用。同时,添加合金元素后将使FeO出现的温度升高,使得抗氧化能力大大提高。图10-17和图10-18所示为在铁中加入铝、硅(质量分数)后钢的抗氧性的变化。
(2)加热温度与保温时间的影响 加热初期氧化层很薄时(<10nm),界面双电场作用强,界面迁移速度一方面取决于浓度梯度,另一方面又取决于电场强度,氧化层厚度与温度之间呈对数关系。
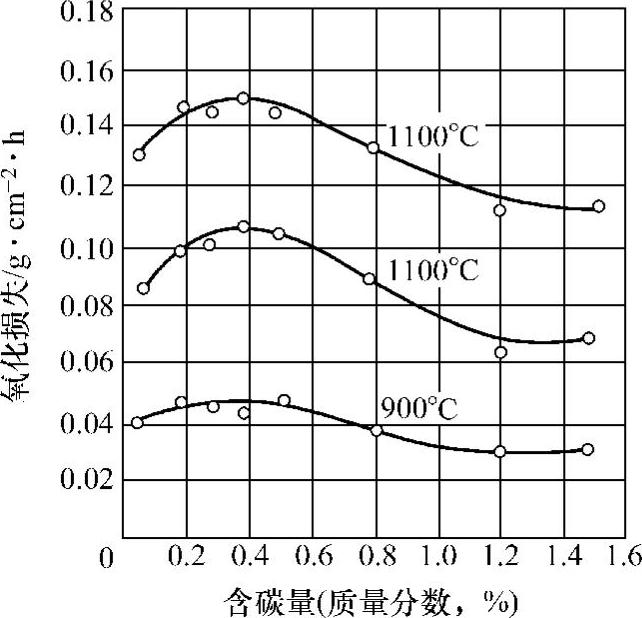
图10-16 碳钢含碳量与氧化速度的关系
氧化层很厚时,氧化速率与层的厚度成反比,此时氧化层的增长速度服从抛物线定律

式中 x——时间τ时的氧化层厚度;
A——常数;
τ——时间。
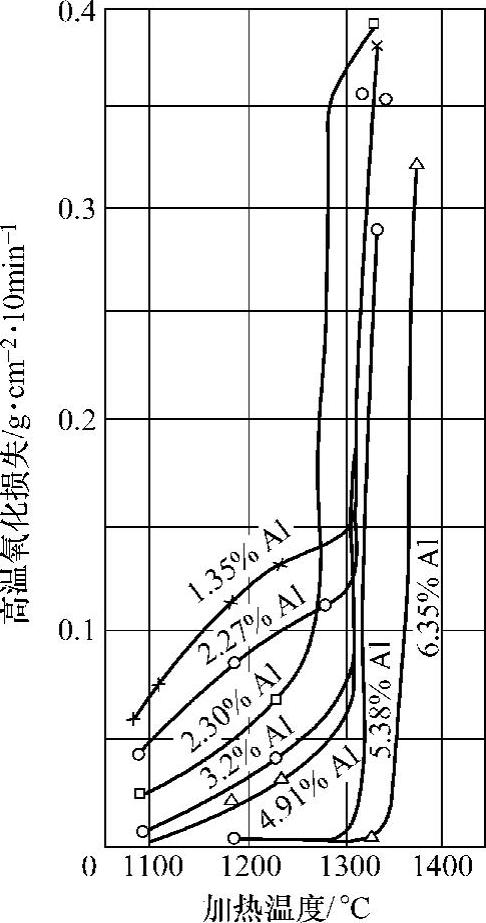
图10-17 铁铝合金氧化烧损与加热温度的关系
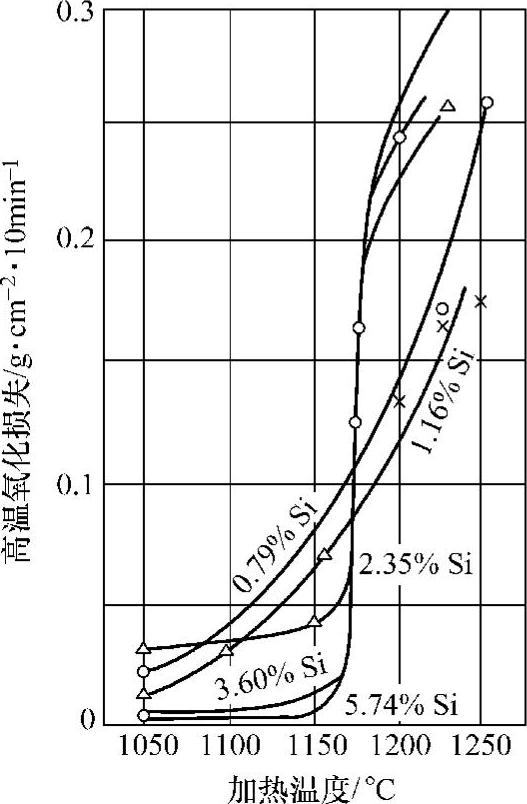
图10-18 铁硅合金氧化烧损与加热温度的关系
图10-19所示为纯铁在空气中加热时保温时间与氧化层厚度的关系。氧的扩散系数与温度呈指数关系,因此,氧化膜的增厚随加热温度升高也呈指数曲线上升。
图10-20所示为wC=0.60%的钢加热温度与氧化速度(用5h内氧化皮增重表示)的关系。
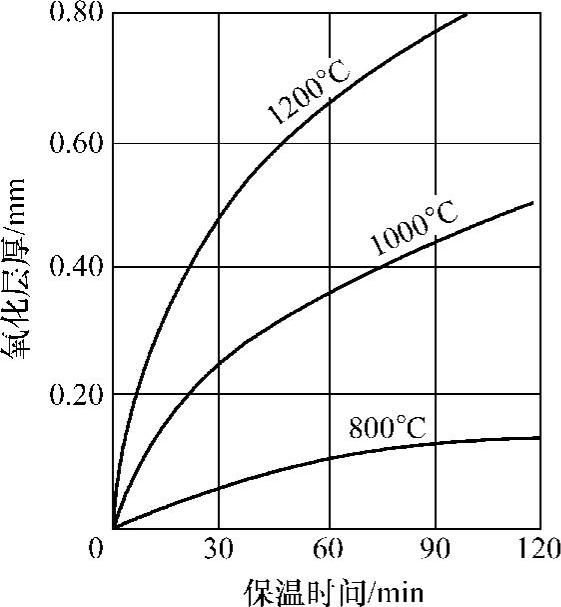
图10-19 纯铁在空气中加热时保温时间与氧化膜厚度的关系
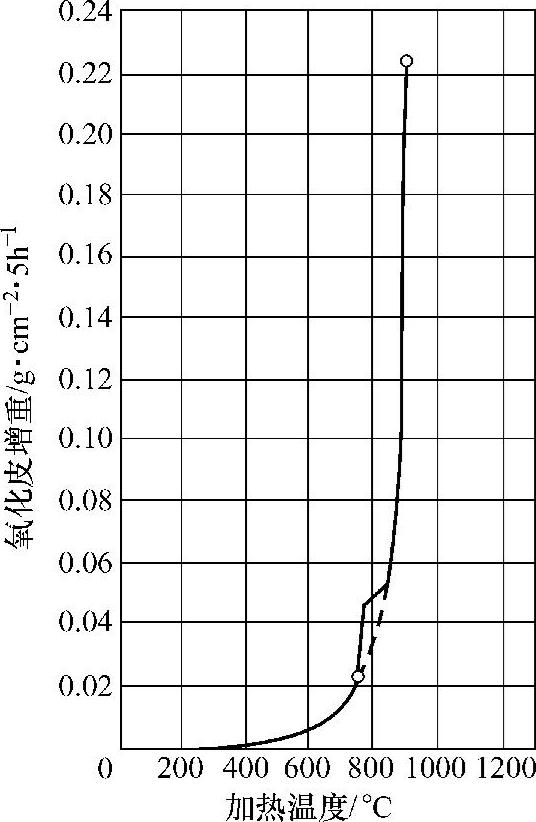
图10-20 wC=0.60%的钢加热温度与氧化速度的关系
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




