在氧化或还原性气氛中加热时,铁与氧化性或还原性气体相互作用,发生氧化还原反应。炉气中的CO、H2是还原性气体,CO2、H2O是氧化性气体,N2是中性气体。钢件表面在这些氧化或还原性气氛中的反应与在纯氧气中的不同,均为可逆氧化还原反应,气氛的氧化还原作用可以控制。
在含有H2及H2O(气态)的气氛中加热时,钢件表面发生下列反应[1]

上述反应的化学平衡常数K1为
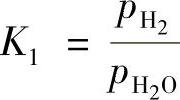
铁与H2/H2O在不同温度下的K1值见表10-1。
表10-1 铁与H2/H2O在不同温度下的K1值

图10-2所示为铁在H2/H2O炉气中的氧化还原反应平衡曲线,在曲线aTb以上为还原区、以下为氧化区,在曲线aTc以下为强氧化区。为了实现无氧化加热,则要求H2/H2O值在1.5~8.0之内。
在高温下,H2/H2O气氛中的水还可以与金属铬发生如下反应

但在H2/H2O/N2氨分解气氛中可以很容易地控制炉气气氛使铬不发生氧化。例如,在1000℃加热含铬的钢时,不会使铬发生氧化的炉气气氛是含水量小于0.03%(体积分数),露点大致为-30℃,即可达到无氧化要求。

图10-2 Fe-H2-H2O系氧化还原反应平衡曲线
当炉气全部由CO与CO2组成时,钢件表面的氧化还原反应如下
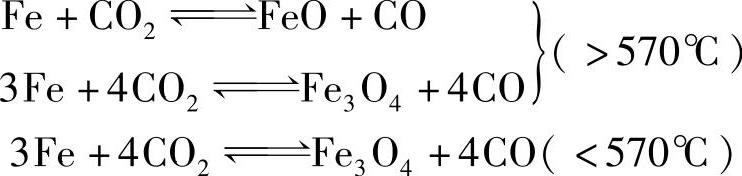
上述反应的化学平衡常数用K2表示,即
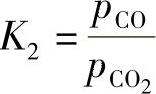
铁与CO/CO2在不同温度下的K2值见表10-2。
表10-2 铁与CO/CO2在不同温度下的K2值

利用表10-2中提供的平衡常数值可以计算出炉气成分。例如,在850℃加热时K2=2.07,若使钢件在CO/CO2炉气中不氧化,根据理想气体的分压比可以用体积分数表示,计算出炉气中CO的体积分数应大于66.8%,CO2的体积分数应小于33.2%。
实际生产中将金属在CO+CO2混合气氛中加热时,既有炉气与金属之间的相互作用,也有炉气之间的相互作用。例如,在木炭发生气中,木炭与空气中的O2、CO2发生燃烧及还原反应,在平衡状态下,反应可写成

上式的化学平衡常数用K3表示,则K3=p2CO/pCO2
常压下(CO+CO2)气体成分与平衡常数K3的关系见表10-3。图10-3所示为三种不同组成的炉气的平衡成分与温度的关系。
表10-3 常压下(CO+CO2)气体成分(体积分数,%)与平衡常数K3的关系
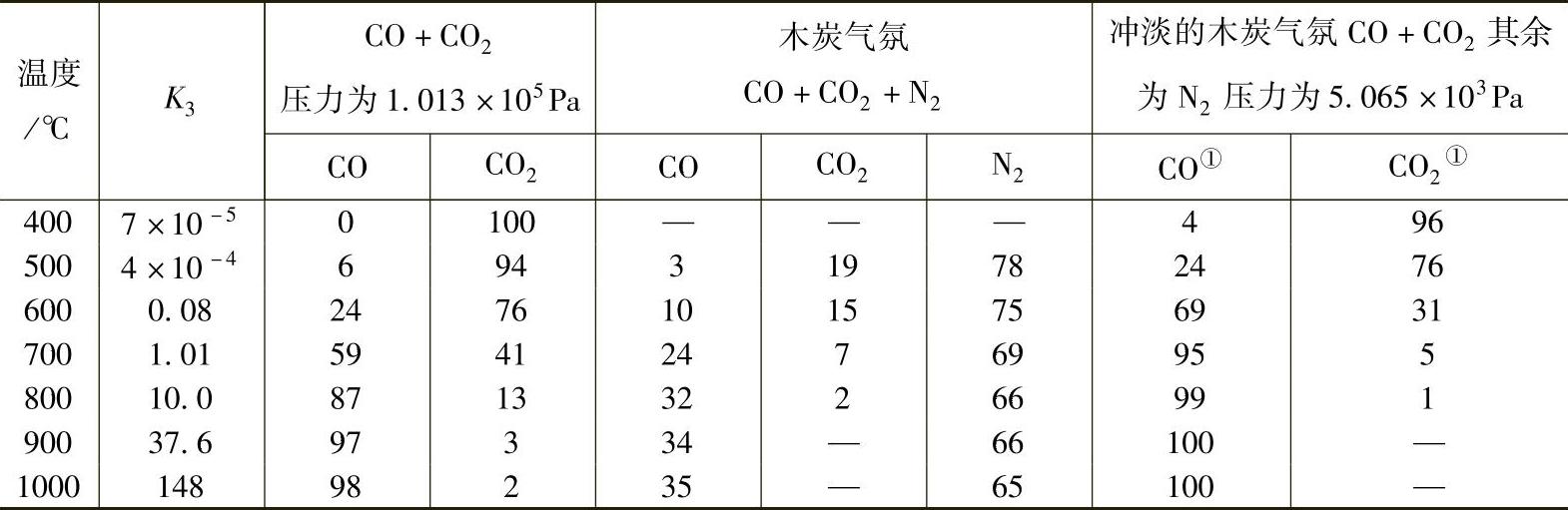
①在CO+CO2的体积分数为5%时。
由图10-3可以看出,对一定成分的炉气来说,随着温度的升高炉气达到平衡状态时,CO浓度需要提高。在CO+CO2+N2的混合气氛中当(CO+CO2)的分压减少时,平衡曲线向左移动。
图10-4所示为钢件在(CO+CO2)混合气氛中的氧化-还原反应平衡曲线,反映了钢件在该气氛中加热时炉气成分与反应性质间的相互关系。在平衡曲线ij的上方发生逆反应,一氧化碳分解为碳与二氧化碳;而在曲线ij的下方,碳与二氧化碳反应形成一氧化碳。在aT线及Tb线的上方,一氧化碳浓度增高,发生还原反应;而在其曲线的下方则发生氧化反应。cT线是反映 的平衡曲线,在cT线的下方,二氧化碳浓度增加,可发生强烈氧化。
的平衡曲线,在cT线的下方,二氧化碳浓度增加,可发生强烈氧化。

图10-3 (CO+CO2)气体平衡成分与温度的关系(Boudcuard曲线)
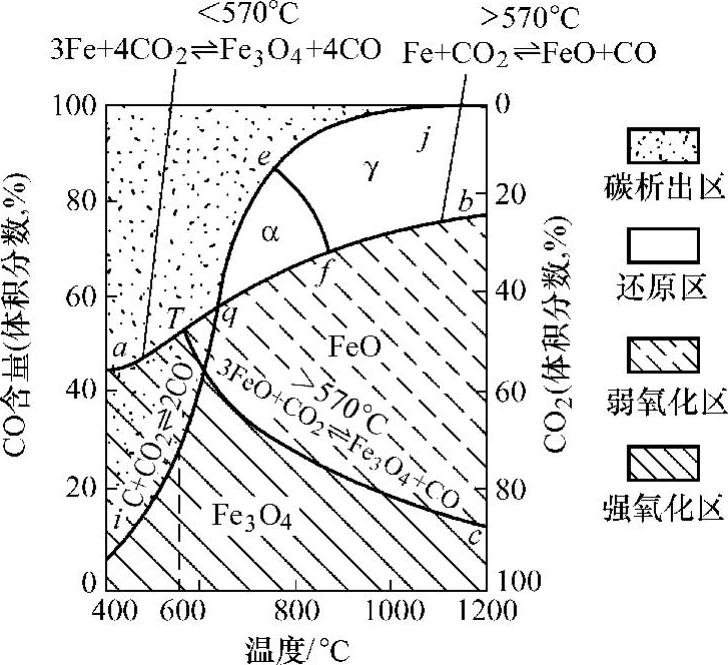
图10-4 钢件在(CO+CO2)混合气氛中的氧化-还原反应平衡曲线
综上所述,可以将图10-4划分成不同的区域;曲线aTc以下影线区Fe3O4稳定存在,是强氧化区;曲线bTc区域FeO稳定存在,是弱氧化区;曲线bqej区域是还原区,不发生氧化,也不在表面沉积炭黑;在高温区,曲线bfej内为γ相存在区,可以在渗碳气氛中发生渗碳反应;曲线fqe内为α相存在区,不发生渗碳反应;在曲线aTpi区域内,一方面表面仍将发生氧化,同时由于铁素体在低温下溶碳甚微,炭黑将在钢件表面沉淀;在曲线aTej的上部区域不发生氧化或渗碳反应,同时将在钢件表面大量沉淀出炭黑,此时也不能实现光亮加热。
当钢铁材料中含有铬时,铬可以和二氧化碳发生如下反应
 (https://www.xing528.com)
(https://www.xing528.com)
如图10-5所示,在700℃铬不发生氧化的条件是lgpCO/pCO2>105,这样高的气体净化程度在实际生产中是不可能达到的,即使在900℃加热要求lgpCO/pCO2>104,技术上也有困难。因此,铬合金及铬钢不能在含有CO+CO2的气氛中实现无氧化加热。
以上分别讨论了在CO/CO2或H2/H2O气氛中的氧化还原反应,但可控炉氛常用的放热式气氛往往是CO、H2、CO2、H2O的混合气氛。
在混合气氛中气体之间将发生水煤气反应

化学平衡常数K4=(pCO2pH2)/(pCOpH2O)=[CO2][H2]/[CO][H2O]。在不同温度下的平衡常数的具体数据参阅表10-4。
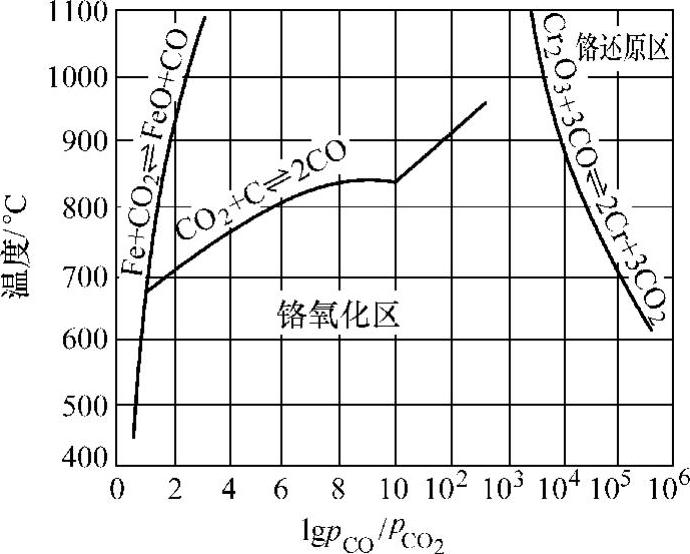
图10-5 CO-CO2气氛与Fe、Cr的 平衡曲线图
表10-4 不同温度下的K4值及在平衡时CO2、H2O的含量(体积分数,%)

铁与CO/CO2及H2/H2O在不同温度下的平衡曲线如图10-6所示,图中实线表示Fe与CO2/CO气体之间的化学平衡,虚线表示Fe与H2O/H2气体之间的化学平衡。从这两条曲线可以看出,温度越高,H2O/H2气氛呈还原性时所需的H2含量越低,CO2/CO气氛呈还原性时所需的CO含量越高。为了防止铁的氧化,在任何温度下保持还原性气氛的极限比例是CO2/CO<4/10,H2O/H2<1/20。

图10-6 铁在CO-CO2及H2-H2O混合气氛中发生氧化还原反应的平衡曲线
图10-6中两类气氛的平衡曲线将该图划分为四个区域:Ⅰ区是还原性气氛区;Ⅱ区是氧化性气氛区;Ⅲ区和Ⅳ区的性质要看混合气的成分及钢的平衡碳势,且与加热温度有关。由于CO-CO2与H2-H2O四种气体混合以后,CO2与H2之间发生化学反应,气体在平衡状态下各组元的比例及氧化能力均发生改变,在图10-6上仅可以作定性的说明。例如,在成分比例为Ⓐ的气氛中加热,高于600℃时处于还原区,不发生氧化;低于600℃时进入H2O/H2气氛的氧化区,将发生氧化。高温加热后如在600℃以下快冷,氧化则很轻微。如果在成分为 的气氛中(CO2的体积分数为5%,CO的体积分数为10%)加热,在850℃以上进入CO2/CO气氛的氧化区,将发生轻微的氧化,但此时同样比例的H2O/H2混合气体的还原作用占优势,仍使整个气氛具有明显的还原性。在冷却过程中进入Ⅲ区以后,CO2/CO气氛的还原作用将超过H2O的氧化作用,因此,出炉的零件是光亮的。要确定混合炉气的氧化还原性质,要根据炉气的实际成分及化学平衡常数进行计算。
的气氛中(CO2的体积分数为5%,CO的体积分数为10%)加热,在850℃以上进入CO2/CO气氛的氧化区,将发生轻微的氧化,但此时同样比例的H2O/H2混合气体的还原作用占优势,仍使整个气氛具有明显的还原性。在冷却过程中进入Ⅲ区以后,CO2/CO气氛的还原作用将超过H2O的氧化作用,因此,出炉的零件是光亮的。要确定混合炉气的氧化还原性质,要根据炉气的实际成分及化学平衡常数进行计算。
在H2/H2O/CO/CO2的多元系气体中,炉气对铁的氧化还原性质的估算可以根据多元系中化学反应平衡常数值进行判断。
由范特荷夫等温方程可知,在标准状态下,一定温度下化学反应的系统自由能变化为

式中 T——绝对温度;
R——气体常数;
Q——在某温度下参与化学反应的各实际分压商;
K——在某温度下的化学平衡常数。
在H2/H2O与钢件表面的氧化还原反应中,系统自由能的变化可由等温方程式给出
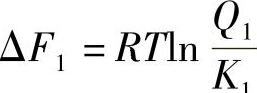
在CO/CO2与钢件表面的氧化还原反应中,系统自由能的变化为

在H2/H2O/CO/CO2混合气氛中加热时,混合气体系统自由能的变化ΔF总是ΔF1与ΔF2之和,即

要使钢件无氧化加热,则必须使炉气气氛保持还原性,即令ΔF总>0,则
Q1Q2≥K1K2
或
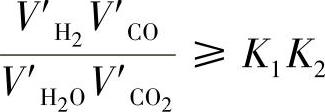
式中,V′H2、V′CO、V′H2O、V′CO2分别为炉气中实际含有的各种气体的体积。
K1值与K2值可分别从表10-1及表10-2中查出。因此,只要已知炉气的实际化学成分,就可以根据上述原理计算出炉气气氛的氧化还原性质。在图10-6中,成分为Ⓑ的炉氛经过测定含量(体积分数)为:10%CO、5%CO2、2%H2O、4H2%,其余为N2。则由前式可以计算得

在1000℃时,查出K1=1.51、K2=2.59,此时K1K2=1.51×2.59=3.91,则有
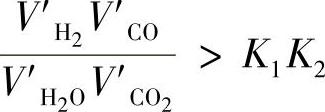
说明该炉气气氛为还原性。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




