1.合金液中气体的来源
铝合金熔液中的气体成分分析表明:氢的质量分数占85%以上,因而铝合金的“含气量”可以近似地视为“含氢量”。铝合金中的氢并不来源于炉气。根据气体分析,大气中氢的分压极微(约5×10-5atm[1]),远比铝液中的氢分压低,从热力学来看,氢在铝液中是不稳定的。研究指出,分子态的氢不能溶入铝液,只有离解成原子态才能进入铝液内。有人在纯净的氢气氛下熔炼合金,结果获得了没有气孔、组织致密的合金锭,可见,炉气中的氢分子不是形成气孔的前提。科学研究证明:铝液中的氢和氧化夹杂物主要来自铝液和水汽的反应。氢的主要来源如下:
(1)空气中的水蒸气 高温铝液与空气中的水蒸气接触时,发生如下反应:
2Al(液体)+3H2O(气体)=Al2O3(固体)+3H2(气体) (1-9)
H2(气体)=2H (1-10)
式(1-9)和式(1-10)两式合并:
2Al(液体)+3H2O(液体)=Al2O3(固体)+6H (1-11)
水蒸气与铝液反应生成的氢气在铝液表面离解为原子氢,进入铝液中,而Al2O3成为夹杂物。
可由相对原子质量求得式(1-11)中各成分的质量比为:
2×27kg∶3×18kg→1×102kg∶6×1kg
假设所产生的氢为标准状态下的分子氢,则将氢换算成体积,上式可表示为
18kg∶18kg→34kg∶22.4dm3化简后得
1g:1g→1.9g∶1.244cm3
上式表明,1gAl与1g水(或水蒸气)发生反应,将生成1.9gAl2O3和1.244cm3的标准状态下的氢气。这说明,即使是极其微量的水或水汽,对铝合金铸造来说,也是不容忽视的产生气孔缺陷的根源。
此外,铝液与水汽的反应也异常激烈。按热力学理论计算,在一般熔炼条件下(例如T=1000K),炉气中水汽分压PH20=0.003MPa,这相当于我国南方及沿海地区夏季大气中的湿度。根据化学反应式计算表明,在反应界面上,即铝液表面的氢分压PH2可能高达1.20×1010MPa,溶入铝液中的驱动力巨大,因而氢大量地溶于铝液中,如果此时操作工具和炉料潮湿则有发生爆炸的危险。
(2)炉气中的水汽 若是使用普通的电炉或感应电炉熔炼,电炉周围的气氛主要是空气,空气里含有水汽。现在很多的铝合金熔铸车间采用反射炉、快速熔化炉、坩埚炉等熔炉,燃烧天然气、重油、柴油、煤油、液化天然气、高炉煤气、焦炭等燃料,这些燃料燃烧的气体中,存在着大量的水蒸气和氢气,造成铝合金熔液的吸气比起电阻坩埚炉造成的吸气量要多得多。虽然使用焦炭和高炉煤气作燃料,其含氢量比较少,但也会使合金的含气量达到0.15cm3/100gAl以上,而使用液化天然气和液化石油气等气体燃料,会使铝合金熔液含气量更高。
(3)炉料带入的水汽或油污 当温度低于250℃时,固体铝锭容易与水汽发生以下反应[7]:
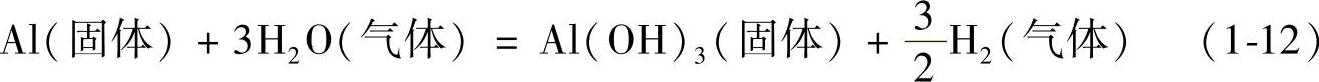
铝锭表面生成的Al(OH)3,组织疏松,呈粉末状,对铝锭没有保护作用,俗称铝锈。
若用带有铝锈的铝锭作炉料,升温大于400℃时发生铝锈分解反应,反应式如下:
2Al(OH)3(固体)=Al2O3(固体)+3H2 O(气体) (1-13)
生成的水蒸气产生式(1-11)所示的反应。此外,分解产物Al2O3组织疏松,能吸附水汽和氢,混入铝液中,也增大气体和氧化夹杂物的含量,使铝液质量变坏。因此,铝锭不宜储存在潮湿的库房内或露天存放,以防止产生铝锈。对有锈的铝锭,投入熔炉前应彻底清除铝锈,否则即使熔炉工艺操作再严格,也不易获得高质量的铝液。
此外,未经充分干燥的炉料、精炼剂、覆盖剂、变质剂中的水分,未经充分干燥的炉衬、坩埚和工具上的涂料所含的水分,残留在坩埚、工具和炉料上的含水熔剂等,都是水汽的来源。
铸造工厂常使用粘附有切削液的切屑,浇冒系统,粘附有印刷油墨乙烯树脂塑料的饮料罐或粘附有油脂的食品罐等铝或铝合金制品,这些制品上的涂料、油脂和非金属有机物均为碳氢化合物,在熔化时会反应生成氢气,分子氢离解成原子氢会被铝合金液所吸收,其反应式为
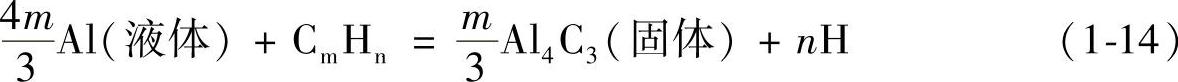
这一反应也是铝液吸氢的原因之一,故生产中应严格禁止将沾有油污的炉料直接投入熔池中,对炉料事先必须进行碱洗处理,清除油污。
2.氢在铝中的溶解度
铝液与水汽反应生成氢气[式(1-9)],氢气溶入铝液中,达到平衡时有如下关系:

式中 Kp——平衡常数;
PH2——氢分压(MPa);[%H]——溶于铝中氢的质量分数(%)。

式中ΔH——氢的溶解热(J/mol);
T——热力学温度(K);
R——气体常数[J/(mol·K)]。
设ΔH与温度无关,解得
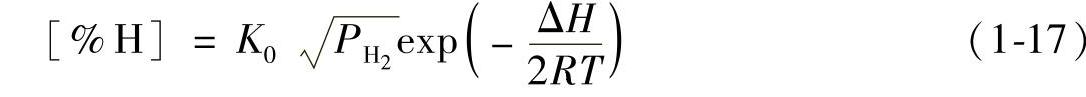
当温度不变时,

式中K0——常数;
KS——温度不变时的参数。
式(1-18)即为有名的Sieverts公式,它说明温度不变时,所有双原子的气体溶入铝液时都服从这个公式。如果不服从这个公式,说明气体和铝相互作用,形成化合物。
工程应用中常使用溶解度方程式的对数式,用符号CH代表[%H]。
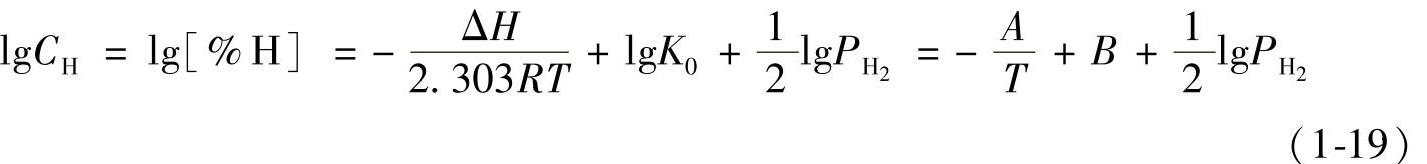
式中的A、B为与合金的化学成分有关的常数。根据不同温度时的溶解度,采用线性回归方法,求得A、B值后,即可求得溶解热ΔH和常数K0。
国际上公认的铝中氢的溶解度公式是用超纯铝(99.998%)在真空条件下通过实验获得的。氢在660~850℃铝液中的溶解度公式为[5]
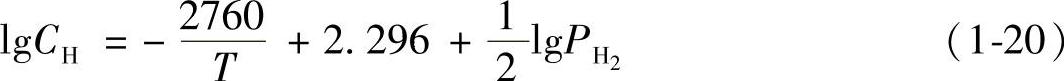
氢在固态铝中的溶解度公式为
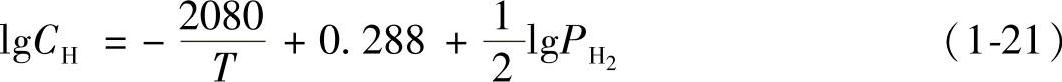
式中CH——氢的溶解度(cm3/100g)。
图1-6所示为几种金属中氢的溶解度变化曲线。由图可知,在铝的熔点温度,从液态转变为固态时,氢的溶解度剧烈下降,在液态铝中的溶解度达0.68cm3/100g,而固态铝中只有0.036cm3/100g,二者之比为18.8倍,二者相差达0.64cm3/100g,相当于1.73%的铝液体积。
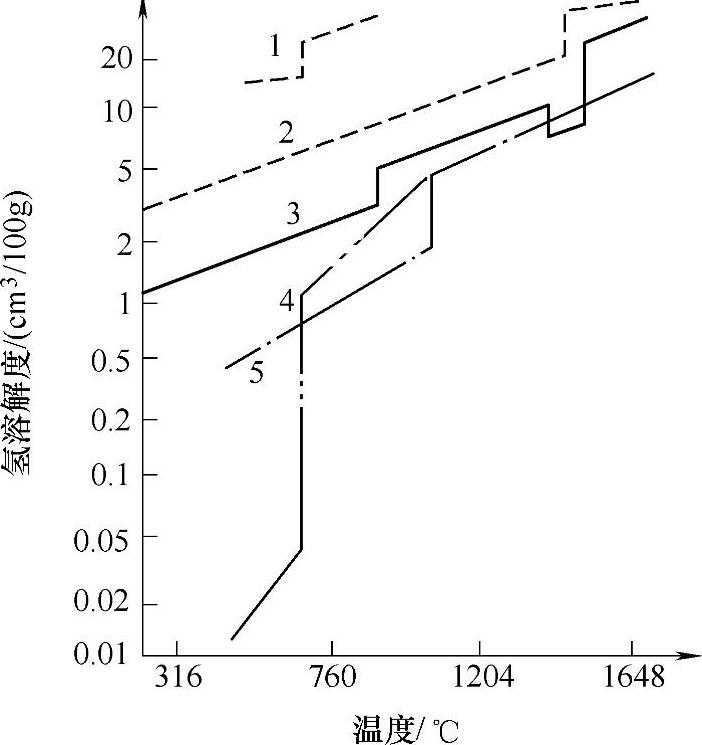
图1-6几种金属在液态、固态下氢的溶解度
1—氢在镁中 2—氢在镍中 3—氢在铁中 4—氢在铝中 5—氢在铜中
3.铝液含氢量的影响因素
(1)铝液吸收氢的动力学 根据热力学计算的结果,只能确定氢在铝液中的溶解过程的限度和方向,因此,要了解吸氢的速度和最终结果,则必须分析铝液吸氢的动力学过程。
铝液吸氢过程可分为以下五步:
1)铝液与液面的水蒸气发生反应生成氢气:2Al(液体)+3H2O(气体)→Al2O3(固体)+3H2(气体)。
2)氢分子撞击到铝液表面。
3)氢分子在铝液表面离解为氢原子:H2→2H。
4)氢原子吸附于铝液表面:2H→2Had。
5)氢原子通过扩散溶入铝液中:2Had→2H。
第五步氢原子的扩散过程是整个过程的限制环节,它决定吸氢的速度。
氢在铝液中的扩散速度可用原子扩散系数D表示。扩散系数与温度及压力的关系为

式中E——扩散热(J/mol);
R——气体常数,8.3145J/(mol·K);
T——铝液温度(K);
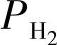 ——氢分压(MPa);
——氢分压(MPa);
K——常数。
从式(1-22)可见,氢分压PH2和铝合金熔体温度越高,扩散系数就越大,吸氢的速度就越大。
在氢分压PH2=0.1MPa的条件下,根据文献报道,在943~1173K的范围内,氢在铝液中的扩散系数可用下式表示:

有铝液对流时的有效扩散系数Def:
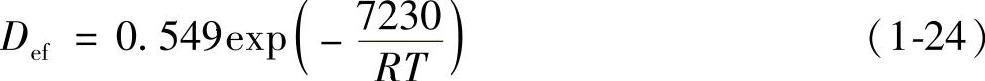
铝液中的合金元素及氧化夹杂物对氢的扩散速度有很大影响,通常降低氢的扩散速度。
(2)氧化铝的形态及性能对吸氢的影响 在室温下生成的表面氧化膜由少量结晶形态的γ-Al2O3和非晶态的Al2O3混合物所组成。根据结构分析,铝及其合金中存在着三种不同形态的无水氧化铝:γ、η和α,它们各自的特性列于表1-4中。随着温度的上升,非晶态Al2O3逐渐转化为η-Al2O3和γ-Al2 O3,到铝熔点附近温度,氧化膜厚度达0.2mm,有较高的强度,Rm≥20MPa。随静置时间的延长,η-Al2O3将逐渐全部转化为γ-Al2O3,在铝液表面形成一层致密的氧化膜,隔绝了炉气和铝液的直接接触,阻滞了铝液的氧化和吸气,对铝液能起保护作用。因此,除Al-Mg类合金外,铝合金可直接在大气中熔炼,不必加覆盖剂,这是γ-Al2O3膜有利的一面。
表1-4 不同形态氧化铝的特性
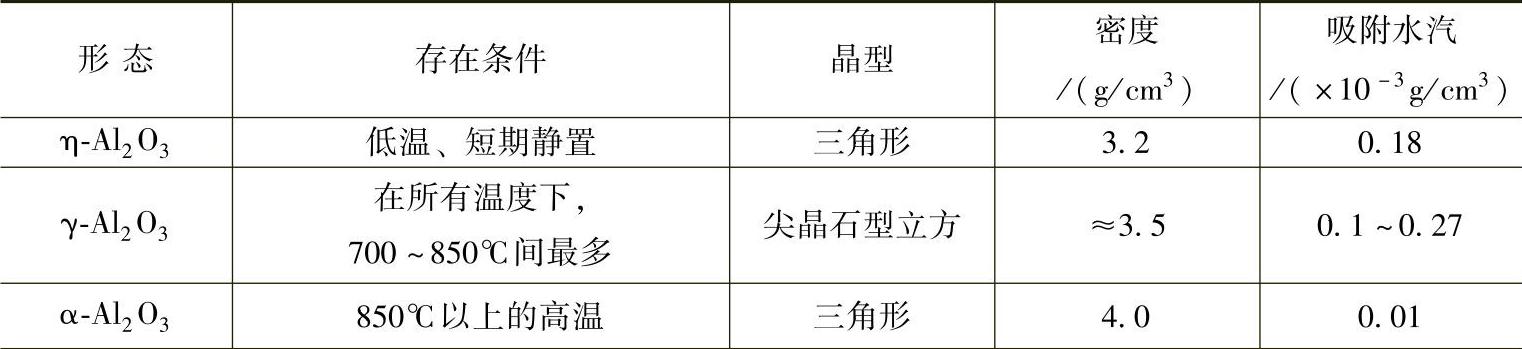
通过观察分析,氧化膜只有和铝液接触的一面是致密的,和炉气接触的一面却是粗糙、疏松的,存在着大量的直径为5×10-3mm的小孔,小孔中吸附着水汽和氢,甚至将γ-Al2O3焙烧到890~900℃,仍能吸附少量水汽,只有当温度高于900℃,γ-Al2O3完全转化为α-Al2O3,才能较完全地脱水。熔炼时搅动铝液,划破连续、均匀地覆盖在铝液表面的氧化膜,铝液便和氧化膜小孔中的水汽反应,使铝液进一步氧化,生成氧化夹杂物,吸入氢气。这样,γ-Al2O3膜就起了传递水汽的作用,成为氢和氧化夹杂物的载体,这就是γ-Al2O3膜的不利的一面。(https://www.xing528.com)
在600~700℃范围内η-Al2O3、γ-Al2 O3吸附水汽和氢的能力最强,因此,铝液中的氢有两种存在形式:溶解氢和吸附在氧化夹杂物缝隙中的氢。前者约占90%以上,后者不足10%。故铝液中氧化夹杂物越多,含氢量也越高。通常,熔池深处氧化夹杂物含量较高,含氢量也较高。可见铝液中的Al2O3和H2之间存在着密切的孪生关系。
前人提出了几种不同的观点来解释这种现象。最早有人根据直流电除气时阴极附近聚集H2这一现象认为Al2O3和H2在铝液中以复合形态的mγ-Al2O3¯·nH+存在,虽然也能解释铝液含氢量和Al2O3含量成正比的事实,但始终没有这种复合物存在的证据。
另一种观点认为Al2O3吸附H2属于化学吸附,在Al2O3夹杂物的周围存在着吸附力场,在吸附力场中氢的吸附方向和扩散脱氢方向相反,因而降低了扩散脱氢的速度。当Al2O3含量足够多,各个吸附力场相互靠拢时,会进一步降低扩散脱氢速度,使除氢发生困难。这种观点能解释“渣多气多”、“渣多难除气”的现象。
近期的实验分别实测了表面粗糙、带有众多缝隙的Al2O3和表面平整的Al2O3吸附氢的情况,发现前者吸附大量氢,后者却不吸附氢,说明Al2O3吸附H2不属于化学吸附,而是物理吸附。
在铝液中卷入Al2O3夹杂物,增加了含氢量,吸附H2的Al2O3又是温度下降时气泡形核的现成基底,所以容易在铸件中形成气孔。
有人对含有不同Al2O3夹杂物量的铝液凝固后形成的针孔率进行了回归分析,证实Al2O3夹杂物量与针孔率之间存在着正的线性相关性,即夹杂物量增加,针孔率也随之增加,且Al2O3夹杂物量低于0.001%后,铝液中不再生成气泡,只形成针孔。因此,为消除铝铸件中的针孔,应遵循“除杂为主,除气为辅”“除杂是除气的基础”的原则。
(3)合金元素的影响
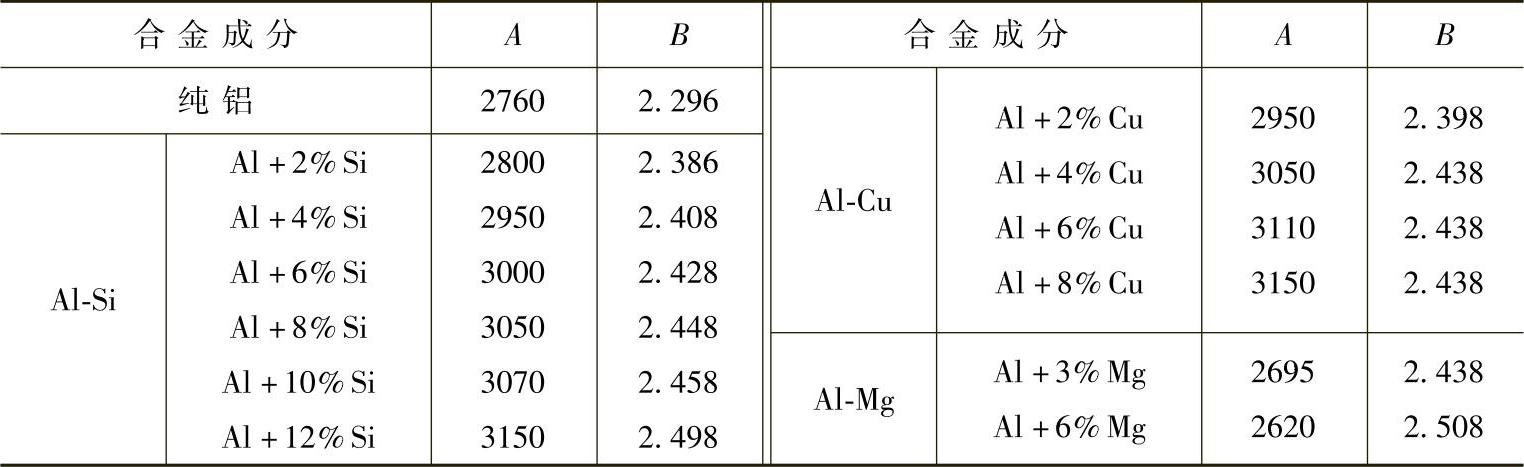
1)合金元素对铝液的氢溶解度有影响。在PH2=0.lMPa的条件下,测得硅、铜、镁对溶解度的影响,按式(1-19)算得常数A、B值列于表1-5中。
从表1-5中可见,铝液中Si、Cu含量越高,氢的溶解度越低。
对于含Mg量的影响,某些学者研究表明,加镁量在一定范围内会增加氢的溶解度。例如,纯铝中氢溶解度为0.9cm3/100g,而w(Mg)=5%的铝合金中氢溶解度升高到1.3cm3/100g,w(Mg)=6%的铝合金中氢溶解度升高到2.9cm3/100g,然而再增加含Mg量,氢的溶解度反而降低,在w(Mg)=9%的铝合金中氢溶解度只有0.7cm3/100g[7]。
此外,w(Ni)=1%能提高氢的溶解度,w(Mn)=1.5%会降低氢的溶解度,Li、Zn等合金元素会增大氢的溶解度[7]。
表1-5 几种铝合金中氢溶解度的常数值
上面所述的合金元素都不形成氢化物,因此,在合金熔液中的氢吸附是有限的。如在铝中加入能形成氢化物的金属元素,则铝对氢的吸附能力急剧增加。例如w(Ti)=2.64%的铝合金能吸附、溶解的氢为24.8cm3/100g,w(Zr)=5%的铝合金能吸附的氢为44.5cm3/100g。
2)合金元素影响氧化膜的性能,从而影响铝液的吸氢。常用合金元素的氧化次序排列如下:Na→Be→Mg→Al→Ce→Ti→Si→Mn→Zn→Cr→Fe→Ni→Cu。Al以后的元素如Si、Zn、Cu等在铝液中不是表面活性元素,密度又较大,不富集在铝液表面,被炉气氧化后和Al2O3组成尖晶石型复杂氧化物γ-Al2 O3·MeO(式中Me代表Zn、Si、Cu等元素)。这种氧化物仍具有γ-Al2O3的晶型,只是晶格常数发生了变化,但其组织致密,对铝液同样有保护作用。
Li、Mg、Na、Ca等与氧的亲和力比铝大,是表面活性元素,密度又比铝小,富集于铝液表面,熔炼时,优先被炉气氧化。铝液中w(Mg)高于1.0%,表面氧化膜即全部由MgO所组成,这层MgO组织疏松,对铝液不起保护作用,故Al-Mg类合金必须在熔剂覆盖下进行熔炼。
在改变氧化膜性能方面,最突出的是铍(Be),它比铝轻,富集在铝液表层,优先被氧化,生成的BeO蒸气压很低,非常稳定。熔炼Al-Mg类合金时,BeO填补了MgO疏松组织中的空隙,使这层复合氧化膜的η>1,对铝液能起保护作用;此外,BeO的电阻很大,能阻止电子交换过程,防止镁原子透过表面氧化膜和炉气接触而进一步被氧化,因此是一种非常有效的防氧化剂。在ZL301合金中加入w(Be)=0.03%~0.07%,就能使氧化速度和纯铝相近,从而保护Al-Mg合金液。
加入硫,和镁反应生成MgS,也能成为氧化膜的填充剂,提高氧化膜的保护功能。
(4)熔炼时间对吸氢的影响 由于在大气中熔炼铝合金,铝液不断被氧化,因此熔炼时间越长,生成的氧化夹杂物越多,吸气也越严重。因此,在生产中,应遵循“快速熔炼”的原则,尽量避免铝液在炉内长期停留。若除气精炼后较长时间内铝液还未浇注完毕,则炉内剩余的铝液可能义重新吸氢,使铝液含氢量再度增高,这种情况下需要再次进行除气精炼(详见后面的1.3节)。
4.铸件中气子L的形成机理
(1)铝液中氢气析出的热力学条件 根据氢在纯铝液中的溶解度公式(1-20),当铝液液面的氢气分压力或水汽的分压力降低的时候,氢的溶解度下降,实际氢含量超过其溶解度时形成过饱和,氢就具有了析出的条件。
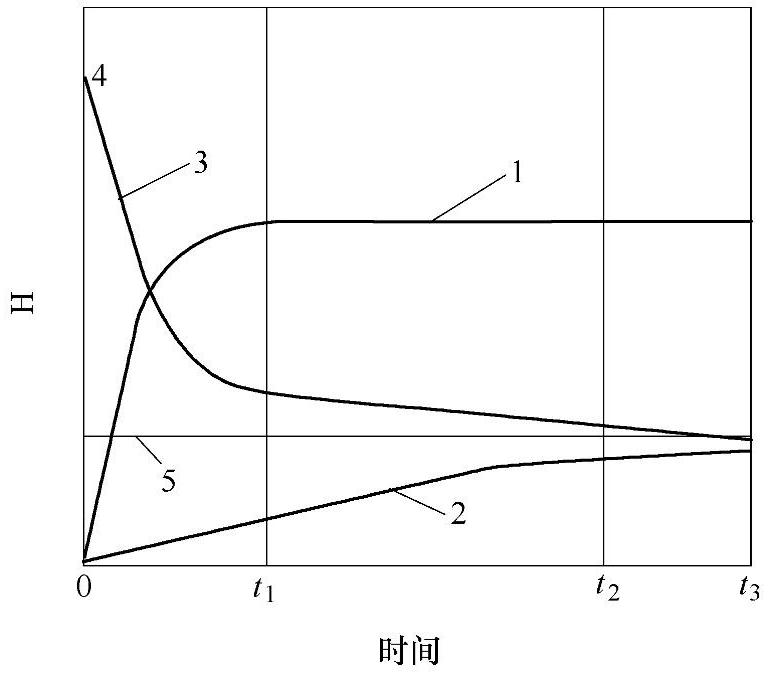
图1-7 铝液析jL氢示意图
1-气泡形式析氢量 2-扩散形式析氢量 3-铝液中实际含氢量 4一铝液中原始含氢量 5-平衡状态含氢量
从图1-6及式(1-20)还可得知,若气体分压力保持不变,铝液温度从高温降到较低温度时,氢的溶解度也降低,氢都将白销液中析出。上述热力学条件能表示析出氢的方向和限度。
(2)动力学过程 若要了解铝液析出氢的速度和最终结果,必须分析其动力学过程。铝液析出氢的动力学过程包括下列几个环节:
1)氢气泡的形成。铝液析出氢的形式及其动力学过程大致如图1-7所示。在时间t1以前,析出氢的形式有二种:一种以气泡形式析出,它是脱氢初期的主要形式:另一种形式为扩散脱氢。
氢气泡形成需要克服外界压力及表面张力的附加阻力,即满足下列条件:
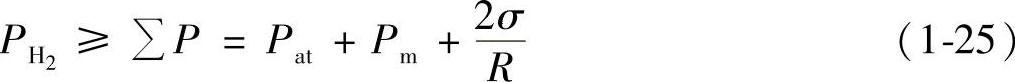
式中 PH2——气泡巾氢的压力(kPa);
∑P——作用在气泡上的外力之和(kPa):
Pat——铝液上方气相中的压力(kPa);
Pm——气泡上方铝液液柱的静压力(kPa),Pm=0.1Hy,其中,H为气泡
上方铝液液柱高度(cm),y为铝液重度(N/cm3);
σ——铝液的表面张力(dN/cm):
R——气泡半径(cm)。
随着铝液中氢含量的降低,PH2变小,在熔池深度为h处,t1时如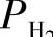 =∑P,
=∑P,
则在熔池深度^以下的铝液中,已不能产生气泡。此时氢的极限含量可表示为
式中 Cn——氢的极限含量(cm3/100g);
K——常数。
在深度h以下的铝液只能靠另一种形式,即扩散脱氢。到时间t2时,铝液含氢量已接近平衡值。到t3时,含氢量到达平衡值,析氢过程终了。
在铝液中含有Al2O3等夹杂物,成为氢气泡的形核基底,使形核变得容易,表面张力的影响2σ/R可忽略不计,式(1-26)简化为

通过式(1-27),进行系列实验,测得Cn值,求出K值,即可作出图1-8。图中阴影区域内,铝液中含氢量既高于平衡状态含氢量,又高于Cn值,因而在此区域内将析出氢气泡。在阴影区下面,熔池深度加大,Cn值相应增大,铝液中含氢量将低于Cn值,已不能产生气泡,但仍高于平衡状态含氢量,将通过扩散析出氢。至阴影区域,氢仍以气泡形式逸出铝液,直至t3时,铝液中氢含量到达平衡值为止。
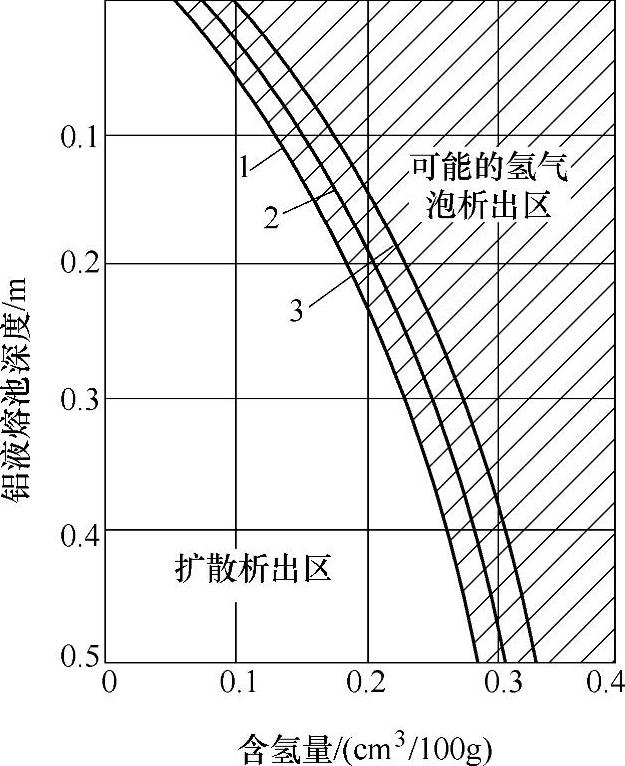
图1-8700℃时炉气压力下铝液中气泡存在的极限深度
1—Pat=13.33Pa 2—Pat=133.32Pa 3—Pat=1333.2Pa
2)铝液中形成的气泡上浮至熔池表面。气泡上浮速度v由Stokes公式估算:
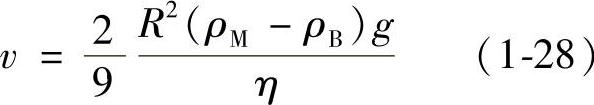
式中 v——气泡上浮速度(cm/s);
R——气泡半径(cm);
η——金属液的动力粘度系数(N·s/cm2);
ρM——金属液的密度(g/cm3);
ρB——气泡密度(g/cm3)。
由于ρM-ρB值很大,气泡上浮快,因此气泡上浮速度通常不是铝液脱氢过程的限制性环节。
虽然氢在铝液中的扩散系数比合金元素在铝液中的扩散系数高2~4个数量级,但在铝液脱氢过程中,扩散却是一个决定脱氢速度的限制环节。
氧化夹杂物明显降低氢的扩散系数,铝液中的合金元素如Si、Mg、Cu、Ti等都降低氢的扩散系数,尤其是氧化夹杂物影响最大,能阻滞铝液脱氢。
铝液由熔池底部向液面定向运动,形成对流,能提高氢的扩散系数,加大氢的扩散速度,促使气泡快速生成、长大的同时,氢快速上浮至液面而被除去,提高除气效果。为此,在生产中可采取下列工艺措施[8-9]:
①电磁搅拌:在熔池内造成强制对流。
②冷凝除气:依靠熔池表面层、坩埚壁的空冷,使铝液产生自然对流。
③真空处理:凭借氢气泡上浮带动铝液产生对流。
采取上述工艺措施后,氢在铝液中的扩散不再是脱氢除气的限制环节。此时,氢气泡通过铝液表面氧化膜成为脱氢过程的限制性环节。
3)气泡通过表面氧化膜逸出。铝液中氢气泡通过表面氧化膜逸出是脱氢过程的最后阶段,铝液的表面氧化膜组织致密,强度高,因此,气泡逸出的速度取决于相界面上存在的氧化膜组织。能破碎、溶解表面氧化膜的熔剂,可消除气泡逸出的屏障,提高铝液脱氢速度,如真空处理时,通常覆盖一层熔剂,氧化膜溶入熔剂中,气泡能顺利逸出,使除气效果大大改善。
在铝液内部,如果氧化夹杂物含量高,氢气泡表面被氧化膜包覆,氢气渗入气泡的扩散受阻,同样成为脱氢过程的限制性环节。如果通入惰性气体Ar或不溶于铝液的活性气体Cl2、C2Cl6、CCl4等,则氢气可直接向这些气体所形成的气泡中迁移,然后被气泡带出液面,从而提高除气速度(见1.3.1节)。
5.气孔的形态及危害
铝液中溶解的气体(主要是氢)若原始含氢量高,则在浇注后的凝固过程中将形成气孔。在铝型材、铸件或制品上产生的气孔缺陷,根据产生的原因分为气孔和微收缩孔。气孔是因为铝合金吸收的气体在铸件(铸锭)凝固时产生,从外表看,多呈圆形,并且表面光滑;而微收缩孔则是伴随着合金在浇注后的凝固收缩而发生的,往往呈尖形,内表面较粗糙。根据气孔的形状大小和分布特点,可把其分为三类:针孔、皮下气孔、集中性大气孔。
(1)针孔 按其大小和分布情况,可分为点状针孔、网状针孔、混合性针孔三类。
1)点状针孔。用放大镜看,外形呈圆点状,轮廓清晰,内壁光滑,可测得其直径和单位面积上的个数。这种针孔是从合金液内析出的气泡所形成,如图1-9所示。

图1-9 ZL101铝合金铸件含 氢量较高时的针孔
2)网状针孔。每个针孔几乎都连接起来,从大面看,呈密集的网状,无法数出单位面积上的孔数和测量其直径,这是凝固温度范围宽的合金在冷却速度很慢时,堵塞封闭在枝晶间隙间的气体不能扩散聚集长大而形成的。
3)混合性针孔。其大小和形状介于前两种气孔之间,用放大镜看,其形状不呈圆点状,而像蜂窝状,有密集区也有稀疏区。
针孔使合金的力学性能和耐蚀性都大大降低,阳极氧化性能和气密性也受到影响,甚至使产品(如厚度δ为0.06mm的铝箔等)报废。
(2)皮下气孔 顾名思义,这是产生在铸件或铸锭表皮底下的一种气孔,其孔内表面光滑,多为铝合金液与湿型砂(潮模)或涂有过厚涂料的钢模发生化学反应而产生的。这种气孔虽对铸件的力学性能、耐蚀性等影响较小,但影响外观和尺寸。
(3)集中性大气孔 集中性大气孔的特点是内壁光滑、比较深,多发生在壁厚较大或靠近补缩冒口处,这是由于这些部位凝固冷却滞后,铸件内的气体受压力影响,向这些部位集中的原因。这种气孔会使铸件报废。
微收缩孔会使合金的力学性能、耐蚀性、气密性下降,导致铸件或型材的报废。
气孔和微收缩孔的产生与合金液的含气量和合金液的凝固速度有关。合金液中含气量越多,则铸件(铸锭)中产生气孔和微收缩孔也越多;合金液凝固时的冷却速度越快(如在金属型中自由铸造、压铸、熔液锻造等),因固溶入合金中的气体量多或在压力下凝固就越不容易产生气孔和微收缩孔。反之,凝固时的冷却速度慢(如在砂型或石膏型中自由铸造)。则即使合金液中含气量很少,也会产生气孔和微收缩孔。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




