镍基合金属于耐蚀合金,般分成三类:①Ni-Mo合金,以哈氏系列合金为主;②Ni-Cr系合金,以Inconel合金为主;③Ni-Cu合金,以蒙乃尔合金系列为主。
镍基合金在很多介质中,甚至在强腐蚀介质中往往具有较好的耐蚀性,良好的力学性能,但因其合金含量很高,价格昂贵,一般不轻易使用。但随着工业的发展,很多场合很难避免,如:醋酸工艺、醋酐工艺中大量使用的哈氏合金材料,在高标号汽油烷基化工艺中也广泛使用蒙乃尔合金材料。表2-22是国外一些耐蚀镍基合金的化学成分和主要用途。
(1)镍铬基合金的耐蚀性 Inconel合金主要用做1000℃左右的高温材料和耐腐蚀的弹性材料,除用做机械密封弹簧或金属波纹管波片外,一般密封产品中很少应用。
(2)镍钼合金的耐蚀性 在镍钼合金中加入的钼含量(质量分数)超过16%后,在盐酸中的耐蚀性显著提高。Hastelloy A、Hastelloy B以及它们的改型合金中钼含量均很高,在盐酸中都具有很好的耐蚀性,尤其是Hastelloy B,对所有浓度的沸腾盐酸都具有良好的耐蚀性,图2-7为Hastelloy合金在盐酸中的腐蚀率。由于不锈钢和大部分其他金属和合金在盐酸中的耐蚀性都很差,因此镍钼合金耐盐酸腐蚀的性能就显得更为可贵。除盐酸外,镍钼合金还能耐硫酸、磷酸、氢氟酸、溴酸、甲酸、醋酸和其他有机酸等非氧化性酸的腐蚀。在氯化铝、氯化镁、氯化铜、氯化锑等非氧化性盐溶液以及湿氯化氢等多种气体中也有很好的耐蚀性。但镍钼合金在含氧化性离子的溶液和硝酸等氧化性酸中耐蚀性不好。在盐酸和硫酸中含有氧化性盐(包括氯化铁、硫酸铁、氯化铜等)时,甚至只有10-6量级的质量分数,也能显著增加镍钼合金的腐蚀率。盐酸中混入微量硝酸即会加剧镍钼合金的腐蚀。盐酸中的溶解氧也会增加镍钼合金的腐蚀。如用镍钼合金制成的盐酸泵,由于泵的入口处与空气接触会加剧入口处的腐蚀。
镍钼合金中的镍含量高,因而具有良好的抗氯化物应力腐蚀能力。又由于钼含量高,对大多数卤素介质具有较好的耐蚀性。常用于含有还原性酸(硫酸,盐酸,氢氟酸,溴酸等)的卤素介质。对制造乙苯过程中使用的氯化铝催化剂有极好的耐蚀性。在制造醋酸和乙二醇的卤化物催化剂系统中也有很好的耐蚀性。
镍钼合金中加入铬,其加入量和耐酸钢类似,即成为镍铬钼合金。SteelloyC,HastellC-4、Hastelloy-276等均属此类。由于它们含有铬,因此能耐氧化性酸如硝酸、硝酸和硫酸的混合酸、铬酸和硫酸的混合酸等的腐蚀。可耐氧化性盐,如三价铁盐,二价铜盐或含其他氧化剂的介质的腐蚀,如温度高于常温的次氯酸盐溶液等。在海水、蚁酸、醋酸、温氯中耐蚀性很好,也可用于含氯和氯化物的介质,但在盐酸中的耐蚀性不如镍钼合金,见图2-8。
(3)镍铜合金的耐蚀性 镍70%铜30%的合金称为蒙乃尔(Monel)合金,是应用最早、最广泛的镍合金。其耐蚀性与镍和铜相似,在一般情况下耐蚀性能更为优越。对非氧化性酸,特别对氢氟酸的耐蚀性非常好。常温下各种浓度的氢氟酸均可使用,在10%的氢氟酸中可用到沸点。对热碱液也有优良的耐蚀性,但不及纯镍的耐蚀性好。可耐中性溶液、高温卤素、低浓度盐酸、各类食品、水、海水、大气等多种有机化合物的腐蚀。不耐氧化性酸和其他强氧化性溶液、熔盐、熔硫和高温气体的腐蚀。Monel在蚁酸中的等腐蚀曲线见图2-9。
Monel合金在硫酸和盐酸中的等腐蚀曲线见图2-10。
图2-10表明了Monel400合金在硫酸和盐酸中的腐蚀率,由于酸中含有空气或铜等氧化性物质而大大加剧其腐蚀。
镍铜合金的力学性能、加工性能和高温性能均很好。加入3%铝(质量分数)的镍铜合金为K-Monel,具有高的抗拉强度,含硅(质量分数)4%的镍铜合金铸件具有较好的耐磨性。Monel合金易产生应力腐蚀,应在530~650℃保温1h退火处理后使用。
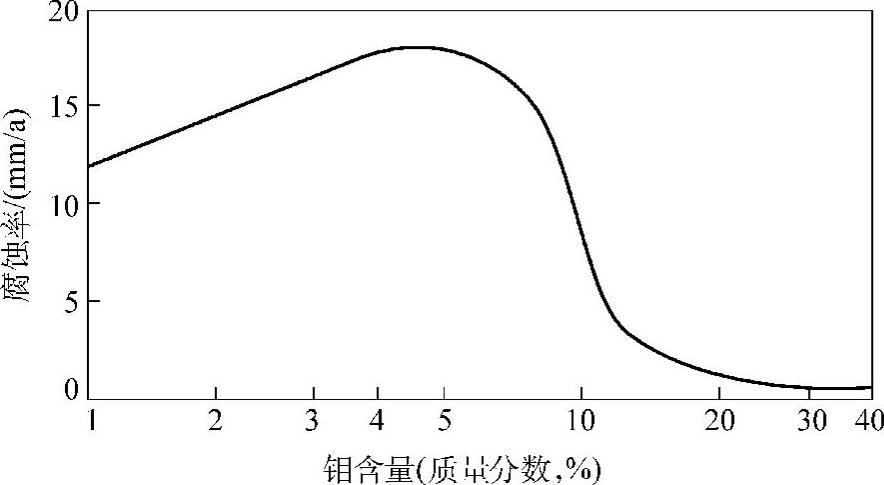
图2-7 Hastelloy合金在盐酸中的腐蚀率
(4)钛和钛合金 钛属于贵重金属,它的相对密度较小、强度高、比强度高,在特定的环境下有着优良的耐蚀性。钛经过合金化后,可使其强度大大增加(应用最广泛的是TC4)。
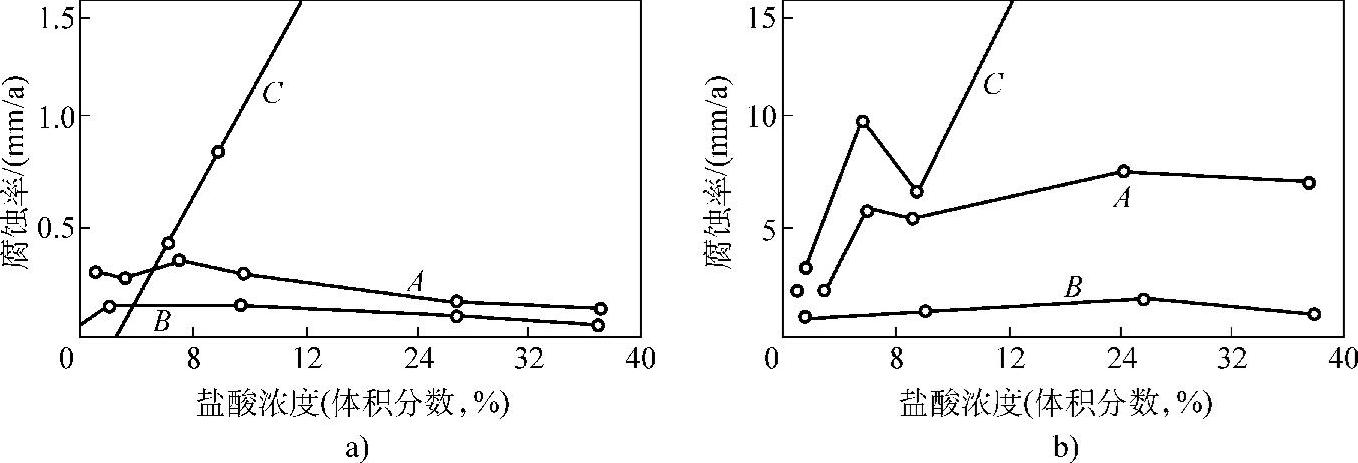
图2-8 Hastelloy合金在盐酸中的腐蚀率
a)70℃ b)沸腾
A—Hastelloy A B—Hastelloy B C—Hastelloy C
1)钛和钛合金的耐蚀性。钛材在中性或弱酸性的氧化物溶液中有高的稳定性,例如:钛和钛合金在100℃的FeCl3(0~30%)、100℃的CuCl2(0~20%)、100℃的HgCl2(所有浓度)、60℃的AlCl3(0~25%)及100℃的所有浓度NaCl中都稳定,钛在许多其他金属的氧化物中,在100%一氧乙酸和100%的二氧乙酸中也是稳定的,因而使钛及钛合金在上述溶液中得到了广泛应用。
钛和钛合金对于含离子的氧化剂溶液也有高的稳定性,如100℃的次亚氯酸钠溶液、氧水、气体(达75℃),含有过氧化氢的氢氧化钠溶液等。
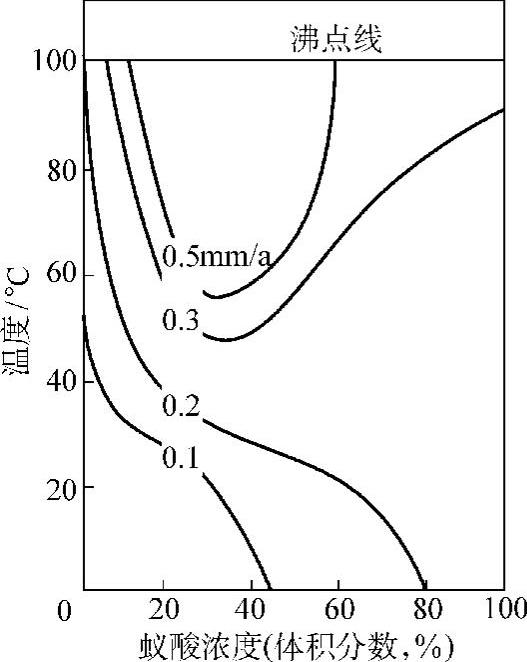
图2-9 Monel合金在蚁酸中的等腐蚀曲线
钛和钛合金在湿氯气中的耐蚀性超过其他常用金属,这是因为氯具有强烈的氧化作用,钛和钛合金在湿氯中能处于稳定的钝态,为了维持钛在氯气中的钝性,需要一定的含水量。临界含水量与氧气压力、流速、温度等因素有关,也与钛设备或零部件的形状尺寸以及钛表面机械损坏程度有关。因此,有关文献中关于钛在氧气中钝化的临界含水量是不一致的,一般认为,0.01%~0.05%可作为钛在氧气中的临界含水量,临界含水量还随氯气温度升高及气流速度降低而相应增加。图2-11为钛在氯气中的稳定性与温度及含水量的关系。
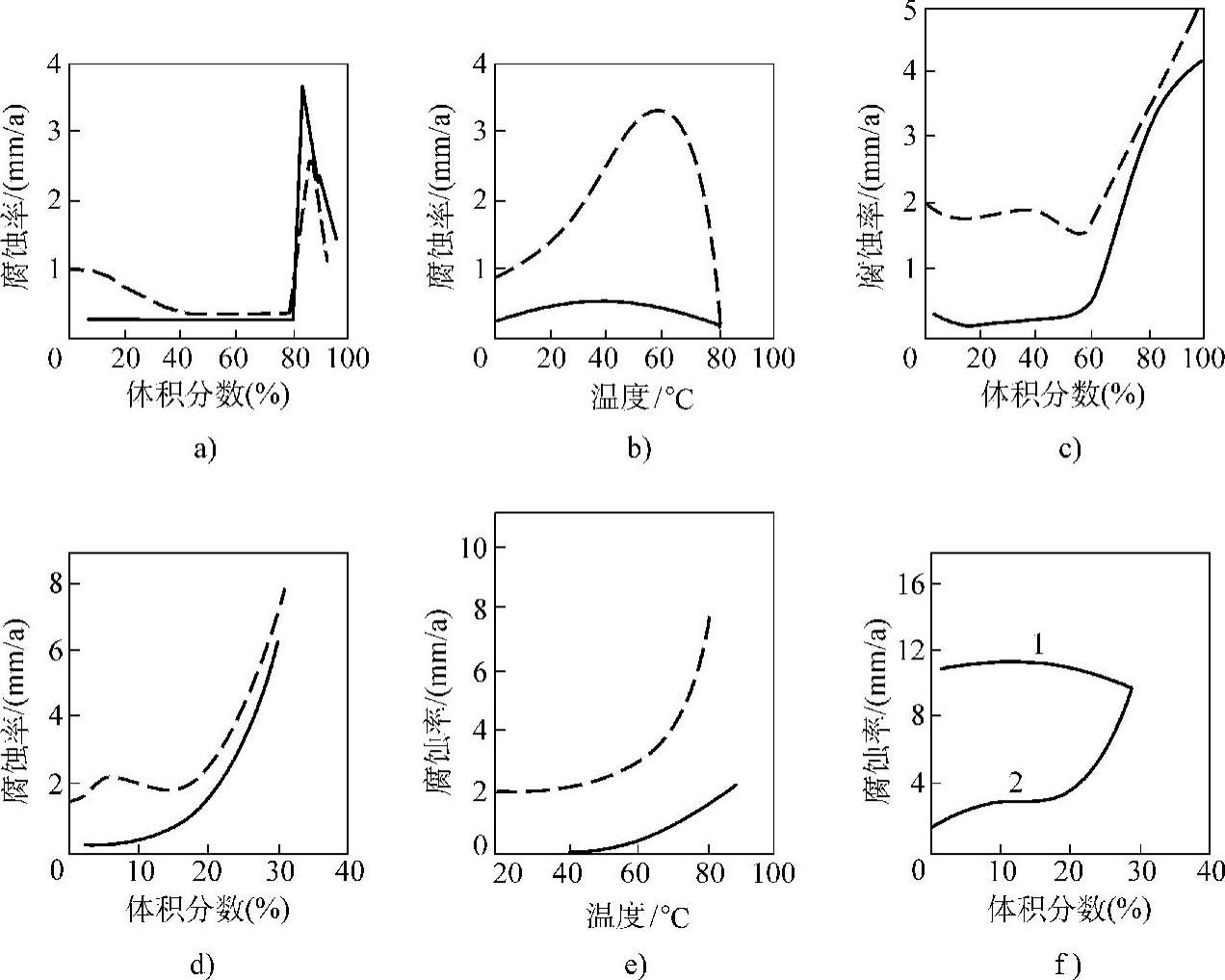
图2-10 Monel合金在硫酸和盐酸中的等腐蚀曲线
a)30℃硫酸 b)5℃硫酸 c)90℃硫酸 d)30℃盐酸 e)5%盐酸 f)空气饱和盐酸
虚线—空气饱和 实线—氢饱和 1—含铜0.5~0.6g/L 2—含铜0~0.03g/L
实践证明,钛和钛合金的表面氧化膜遭到破坏后,需要较高的含水量才能使钛和钛合金重新钝化。
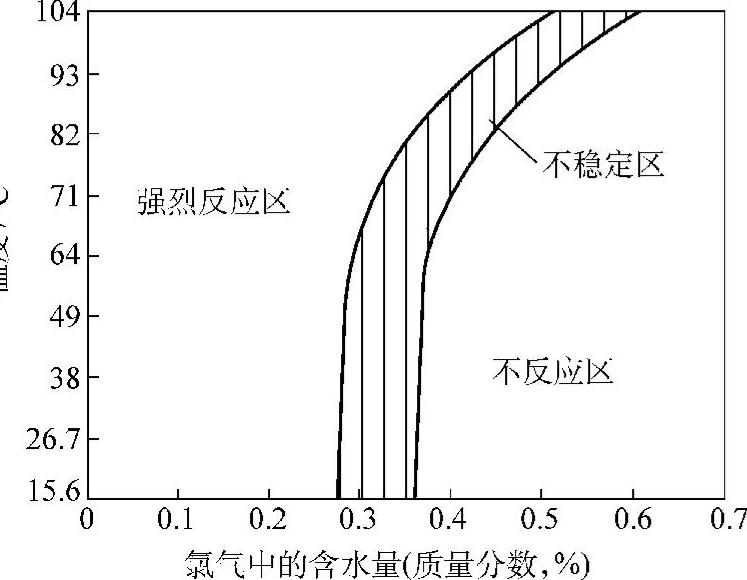
图2-11 钛在氯气中的稳定性与温度及含水量的关系
钛和钛合金在干氯气中,甚至在0℃以下也会发生剧烈反应生成四氯化钛,并有着火危险。钛和钛合金在干氯气中的反应一经开始,其破坏就是崩溃性的,再加入水也不能阻止反应的进行。
关于钛在氯气干、湿界区的行为尚未完全弄清,根椐热力学分析,钛与氯在室温下不能以平衡状态存在,根椐热力学自由能可知,在这个反应系中生成稳定化合物四氯化钛与水不共存,会进一步反应,即
TiCl4+4H2O→Ti(OH)+4HCl
因此,关于氯与钛的反应可以做简单的解释:钛与氯反应会生成四氯化钛,室温时四氯化钛是液体,其沸点为136℃,生成四氯化钛的反应伴随着放热过程。如果氯气处于干燥状态,释放的大量的热使反应达到很高的温度,当温度达到钛熔点时,钛开始燃烧。此后,只要有足够的干氯,反应将激烈进行,直到反应物耗尽。但是,如果氯气中有足够的水分,四氯化钛会与水作用生成氢氧化钛,它是一种非挥发性的物质,该物质成为一种膜牢固附着在钛的表面,这一反应是极稳定的反应,而且表面膜在湿氯中极为稳定。因而钛在湿氯中具有优异的耐蚀性,其稳定性与氯气中含水量密切相关。钛在多种有机物中的耐蚀性见表2-23。(https://www.xing528.com)
表2-23 钛在多种有机物中的耐蚀性
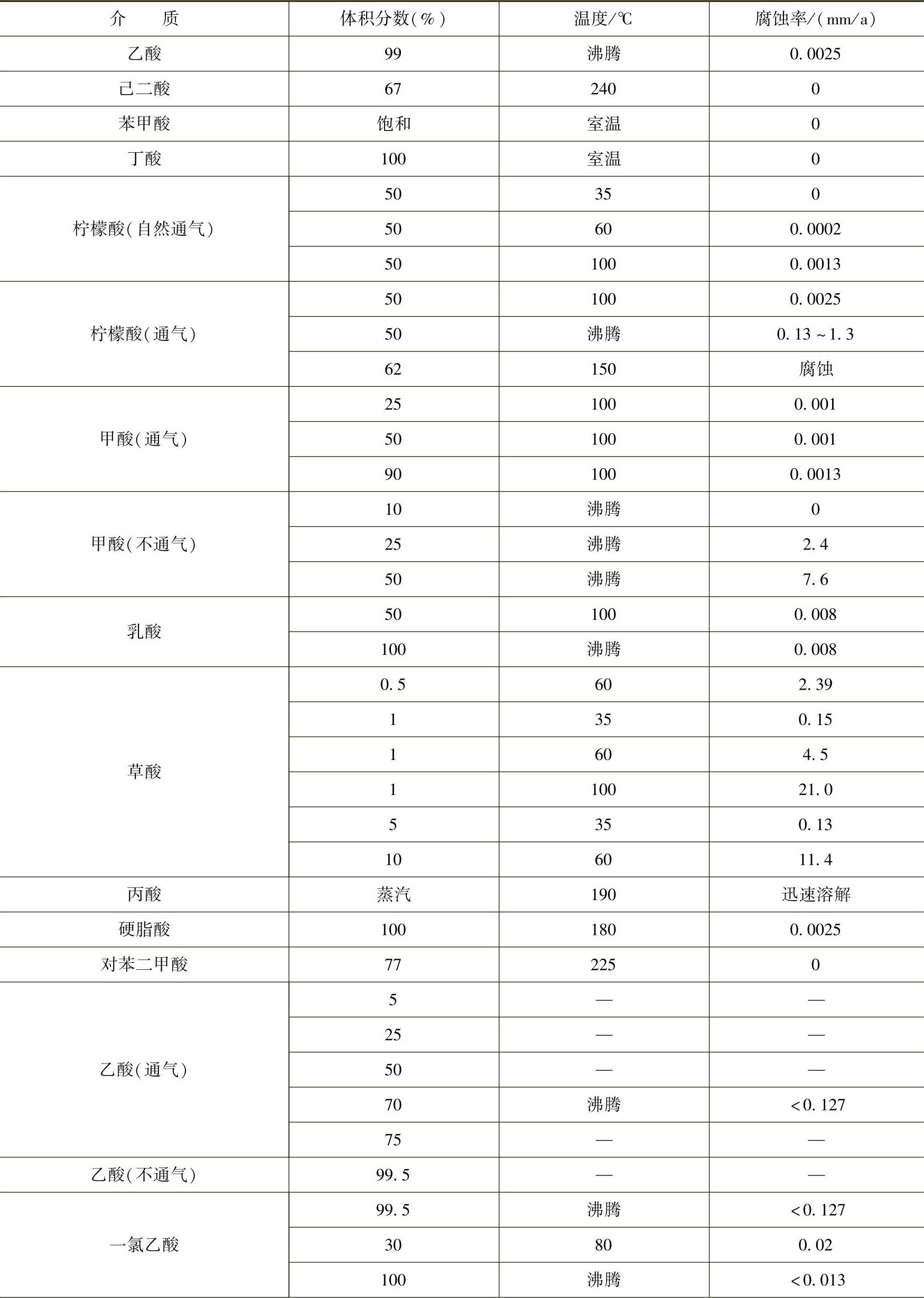
(续)
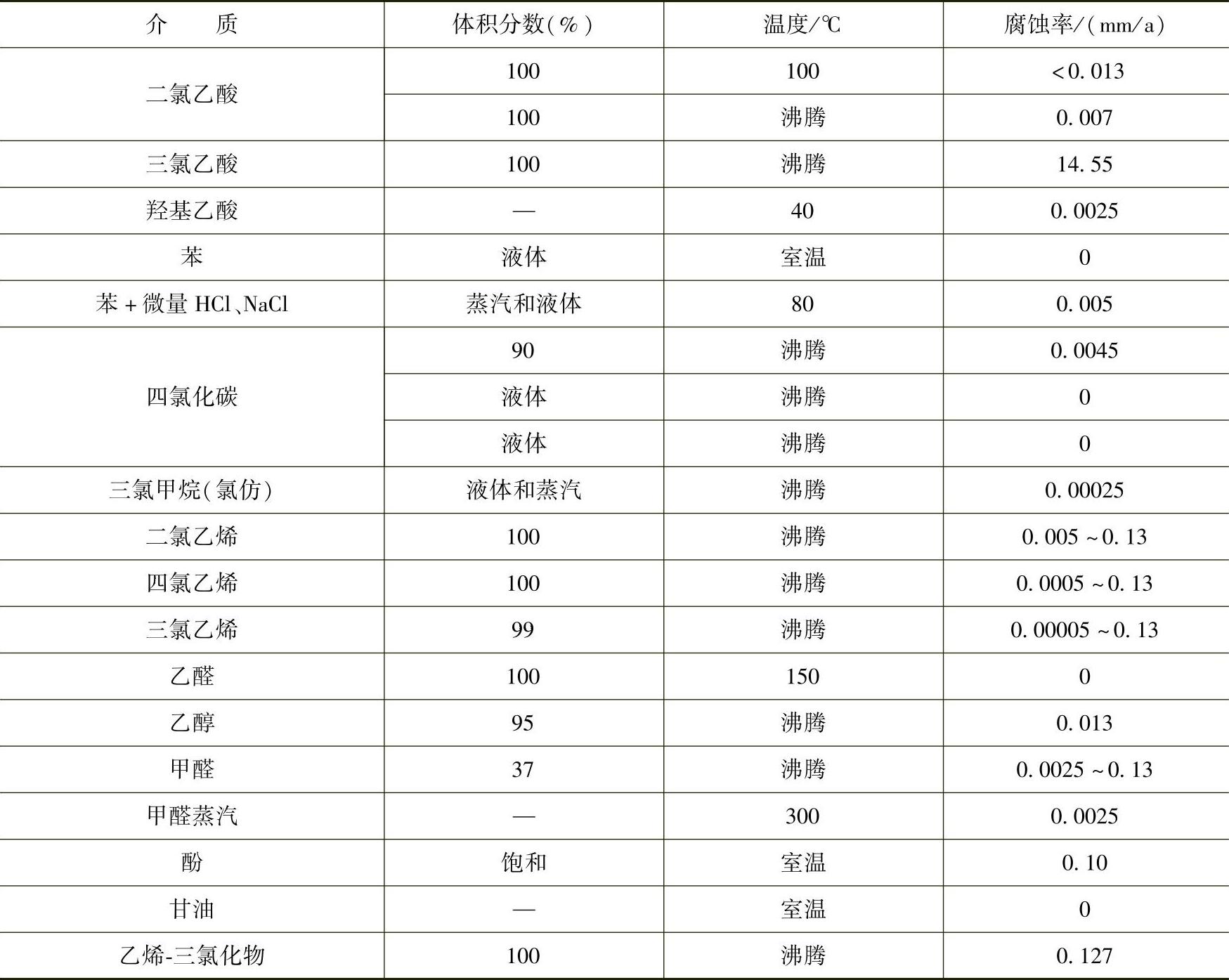
钛和钛合金在汽油、甲苯、苯酚、甲醛、三氯乙烷、醋酸、柠檬酸、一氯代乙酸等中具有较高的耐蚀性,但是在沸点及不充气的情况下,钛在25%以下的甲酸中会受到严重腐蚀,在含乙酸酐的溶液中,钛不仅受到严重的均匀腐蚀而且会产生孔蚀,对于许多有机合成过程中所接触的复杂有机介质,如生产环氧丙烷、苯酚、丙酮、氯代乙酸等化学介质中,钛和钛合金的耐蚀性优于不锈钢和其他结构材料。
2)钛和钛合金在酸溶液中的耐蚀性。在稀盐酸、硫酸和磷酸中,钛的溶解比铁缓慢得多。随着介质浓度的增加,特别是在温度升高时,钛溶解的速度显著加快,在氢氟酸和硝酸的混合物中钛溶解得很快。
硝酸是一种氧化性酸,钛在硝酸中,其表面能保持一层致密的氧化膜,随着硝酸浓度的提高,这层表面膜呈现微黄、淡黄、土黄、棕黄到蓝色的各种干涉色。氧化膜的完整性是维持钛耐蚀性的必要条件。因此,钛在硝酸中有十分优良的耐蚀性,钛的腐蚀速率随着硝酸溶液的温度升高而增大,温度在190~230℃,硝酸质量分数在20%~70%之间,其腐蚀速率最高可达近10mm/a。图2-12为钛在高温硝酸中腐蚀速率。
但是硝酸溶液中加入少量含硅化合物,可抑制高温硝酸对钛的腐蚀。例如,在质量分数为40%的高温硝酸溶液中加入聚硅氧烷油后,腐蚀速率可降低到几乎等于零。也有资料介绍,在500℃以下,钛在质量分数为40%~80%的硝酸溶液和蒸汽中具有高度的耐蚀性。相反,在硝酸中加入磷化物则导致钛腐蚀加速,利用钛的这一特性可以配制它的酸洗液。在发烟硝酸中,当二氧化碳质量分数在2%以上时,由于含水量不足引起强烈的放热反应而导致爆炸。发烟硝酸的成分对钛发生爆炸可能性的影响如图2-13所示。
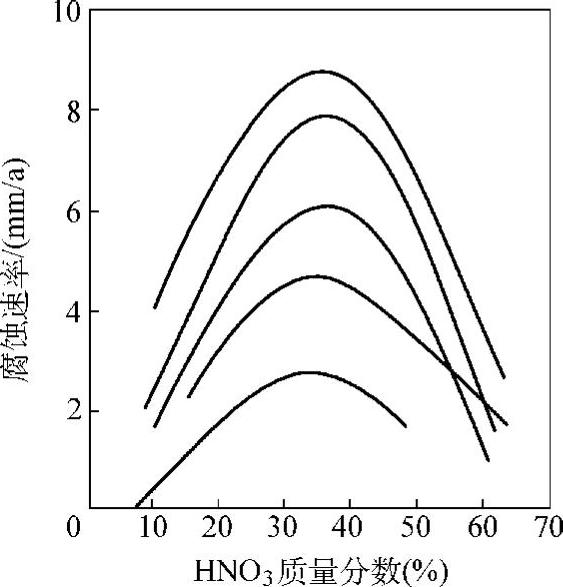
图2-12 钛在高温硝酸中的腐蚀速率
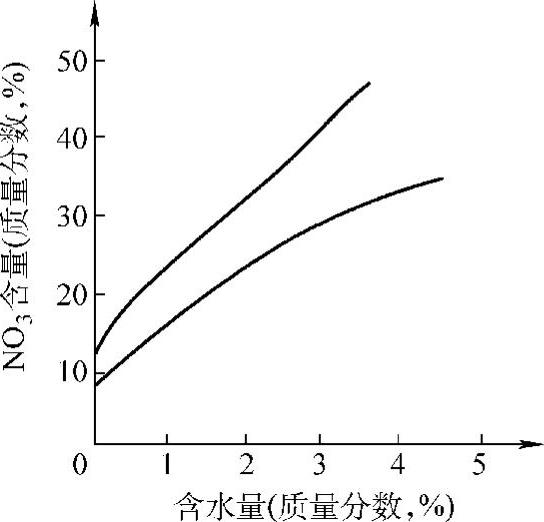
图2-13 发烟硝酸的成分对钛发生爆炸可能性的影响
但是钛在质量分数为80%或更低的硝酸中不会发生爆炸,在170℃、质量分数为20%~80%HNO3中的试验已证实了这一结论。钛在80%以上高温硝酸中应用的可能性,从安全考虑,尚需做进一步研究,在低于500℃的温度下,钛在硝酸盐的熔融混合物(50%KNO3+50%NaNO2和40%NaNO3+7%KNO3+53%NaNO2)中不会有燃烧、爆炸反应的倾向。
硫酸是强还原性酸,钛对低温、低浓度的硫酸溶液有一定的耐腐蚀能力,在0℃时,可耐体积分数达20%的硫酸腐蚀,随着酸的浓度和温度的升高,腐蚀率增加。因此钛在硫酸中的稳定性差,甚至在溶解氧室温下,钛只能耐体积分数达5%的硫酸腐蚀,在100℃下,钛只能耐体积分数达0.2%的硫酸腐蚀,氯对钛在硫酸中的腐蚀有抑制作用,但在90℃,硫酸体积分数为50%时,氯反而引起钛腐蚀加速,甚至引起着火。钛在硫酸中的耐蚀性可通过向溶液中通入空气、氮气或添加氧化剂、高价重金属离子来改善。能起缓蚀作用的主要添加剂是高价铁、高价铜、Ti4+、铬酸银、二氧化锰、硝酸、氯气以及有机缓蚀剂α-亚硝基化合物,醌和蒽醌衍生物还有某些络合型缓蚀剂。总体来说,钛在硫酸中无太大的实用价值。
盐酸是还原性酸,钛在盐酸中,即使在室温下,它的稳定性也比较差。腐蚀率随酸溶液的浓度和温度的升高而逐渐增加。因此,钛材一般适应于常温、体积分数为3%和100℃、体积分数为0.5%的盐酸溶液中工作,钛虽然不耐盐酸溶液的腐蚀,但也可通过合金化、阳极钝化和添加缓蚀剂等方法来提高钛材的耐腐蚀能力。属于强氧化无机化合物类是钛的最有效缓蚀剂其中有硝酸、重铬酸钾、次氯酸钠、氯气、氧以及高价重金属离子(主要是Fe3+、Cu2+、少量的贵金属);有机缓蚀剂有氧化性有机化合物,偶氯化合物、醌和蒽醌衍生物、杂环化合物、络合型缓蚀剂,所以在生产实践中,仍有使用价值。
磷酸也属于还原性酸。钛在磷酸中的腐蚀率比在盐酸或硫酸中低,但比在硝酸中高。钛一般适用于20℃、质量分数为30%或35℃、质量分数为20%通气或不通气磷酸。钛在磷酸中的耐蚀性随酸浓度与温度的升高而渐增,这与钛在盐酸中的情况相似。
钛在磷酸中发生如下腐蚀反应,即
2Ti+2H3PO4=2TiPO4+2H2
与钛在硫酸、盐酸中的情况相似,磷酸中加入氧化剂或其他缓蚀剂有利于改善钛在磷酸中的耐蚀性。银、汞也有利于改善钛在磷酸中的耐蚀性。硝酸是有效的氧化剂。
氢氟酸和氟硅酸是最强的腐蚀介质,即使在常温、极稀的氢氟酸中,钛也会遭到强烈的腐蚀。因此,钛在氢氟酸中完全不能应用。钛不仅在氢氟酸中遭到迅速腐蚀,而且在含氟的酸性介质(如氟硅酸、氟硼酸)中亦会遭到强烈腐蚀。钛与氢氟酸的腐蚀反应为
Ti+6HF=TiF3+3H2
TiF3是多孔的腐蚀产物,无任何保护作用,因而腐蚀会快速发展,钛在与氢氟酸与盐酸或硫酸的混酸中更易溶解。除因浓酸与金属相互作用使钛腐蚀外,F-与Ti4+的络合作用加速了钛的溶解,这一反应为
Ti+6HF=TiF62-+2H++2H2
在其他酸如氢溴酸、高氯酸、甲酸、乙酸中加入少量可溶性氟化物会使钛的腐蚀率增加几十倍。酸性氟化物溶液,如NaF、KHF2也会使钛遭到严重的腐蚀。在氢氯酸中尚没找到理想的缓蚀剂。
但是有机酸中除了甲酸、草酸和相当浓度的柠檬酸之外,钛都不会被腐蚀。例如在乙二酸、丁酸、乳酸、顺丁烯二酸、羟基丁二酸(苯果酸)、丹宁酸和酒石酸等有机酸中,钛的耐蚀性很强。
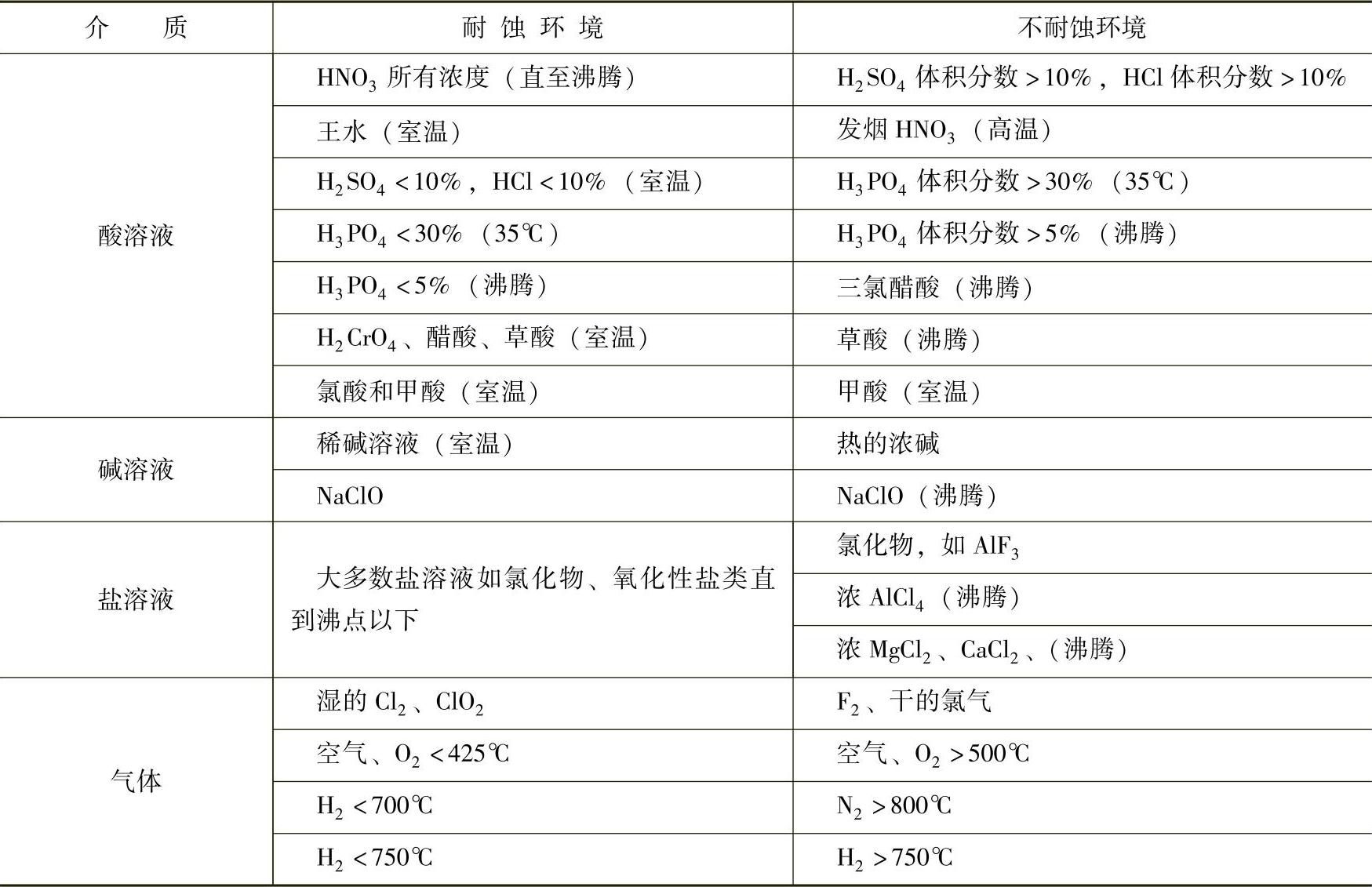
3)钛在碱中的耐蚀性。在稀碱溶液(体积分数低于20%)中,钛是稳定的;在较浓的碱溶液中,特别当加热时,它缓慢地作用生成钛酸盐。钛在大多数碱溶液中具有良好的耐蚀性,腐蚀速率随着溶液的浓度和温度而渐增,在碱溶液中有氧、氨或二氧化碳存在时,会加速钛的腐蚀,在含有过氧化氢的碱溶液中,钛的腐蚀性很差。但在氢氧化钠溶液中也有较强的耐腐蚀能力。如钛在130℃、73%氢氧化钠溶液中的腐蚀速率仅为0.18mm/a,钛与其他金属所不同的是它在氢氧化钠溶液中不会产生应力腐蚀破裂,但长期暴露可能产生氢脆。因此,钛在苛性碱和其他浓度碱溶液中使用温度应是≤93.33℃。表2-24所示为钛在各种环境的耐蚀性。
表2-24 钛在各种环境中的耐蚀性
由以上叙述不难看出,钛是化学工业中最有前途的耐蚀材料,特别值得指出的是,它在动、静海水和海洋大气中都完全耐蚀,甚至超过了某些耐蚀材料。
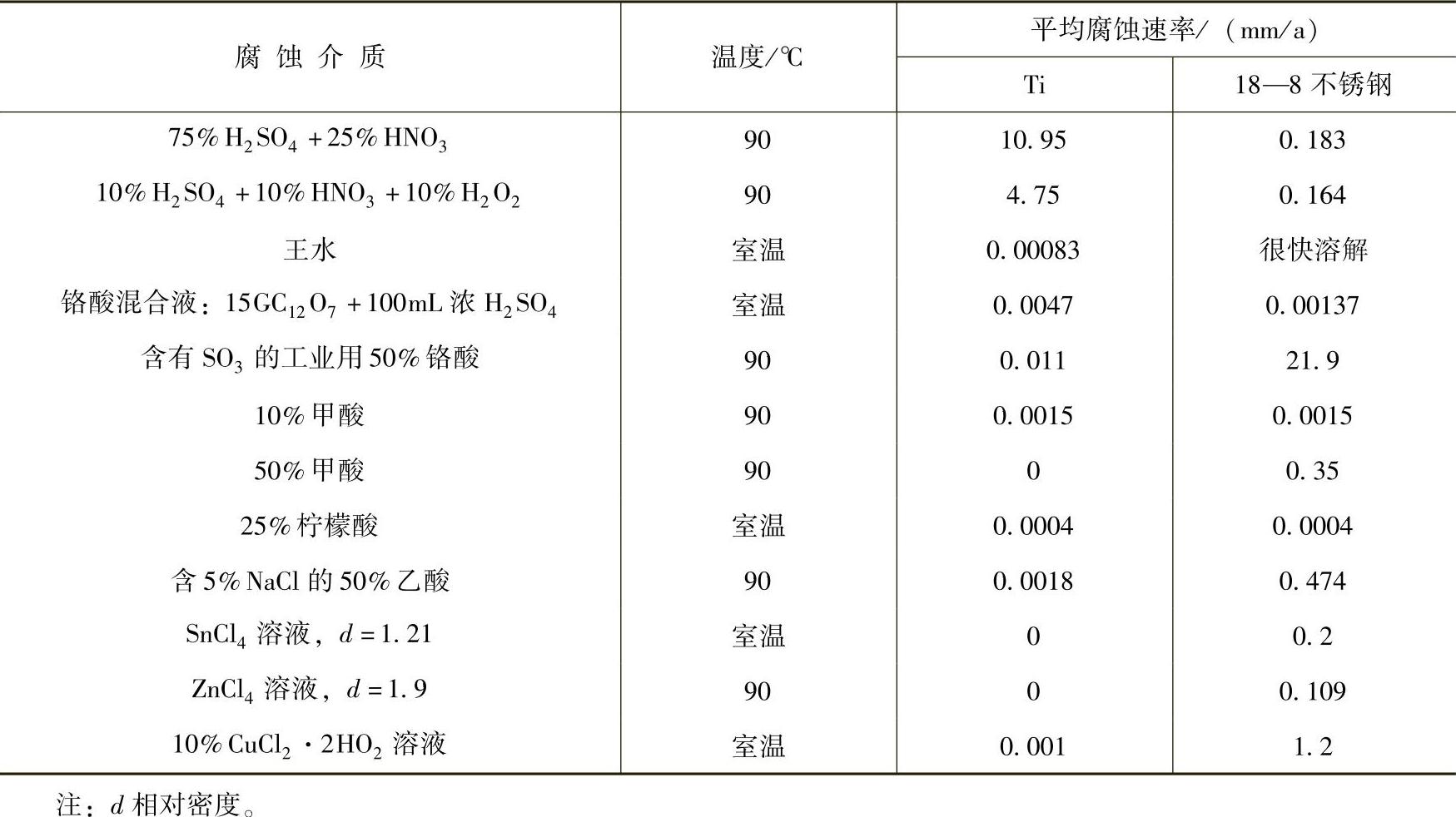
钛和18—8不锈钢的平均腐蚀速率见表2-25。
表2-25 钛和18—8不锈钢的平均腐蚀速率比较
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




