铝是活泼金属,电负性为1.61,但由于Al3+电荷高、半径小,具有很强的极化能力,所以铝的化合物既有共价型,也有离子型。例如,Al3+与难变形的阴离子结合时,形成离子型化合物,如Al2O3、AlF3等;而与易变性的阴离子结合时,形成共价化合物,如AlCl3等。铝的化合物以共价化合物为主。在形成共价化合物时,铝也是缺电子原子,铝的化合物是缺电子分子。铝的重要化合物有Al2O3、AlCl3、Al2(SO4)3·18H2O等,它们在工业中有很多重要的应用。
1.氧化铝
加热氢氧化铝[Al(OH)3]可使其脱水生成氧化铝(Al2O3)。在不同的温度条件下制得的Al2O3可以有不同的形态、不同的用途。目前制得的Al2O3至少有8种同质异晶(某些统一化学成分的物质,在不同条件下结晶成不同的晶形)的形态,一般用希腊字母分别表示成α-Al2O3、β-Al2O3、γ-Al2O3等。其中主要的有两种,即α-Al2O3与γ-Al2O3。
自然界中存在的结晶氧化物是α-Al2O3,称为刚玉;Al(OH)3热分解得到的α-Al2O3称为人造刚玉。刚玉的化学性质稳定,不溶于水,也不溶于酸或碱,在催化剂中常用作载体;它有很高的熔点,可作耐火、耐高温材料。例如,用含少量Fe3O4的刚玉粉制得的坩埚可烧至1 800℃。α-Al2O3有很高的硬度(仅次于金刚石),可作高硬度材料和耐磨材料。纯的刚玉是白色不透明的,俗称白刚玉,若有少量杂质,便可呈现鲜明的颜色。例如,在α-Al2O3中含有少量Cr(Ⅲ)时,可制成红宝石,含少量铁(Ⅱ)、铁(Ⅲ)和钛(Ⅳ)的氧化物时,可制成蓝宝石。各种宝石均可用于制造机械轴承、钟表及各种饰品。
γ-Al2O3的化学性质与α-Al2O3的不同,它既能溶于酸,也能溶于碱,是典型的两性氧化物,被称为活性氧化铝,其硬度不高,化学性质较α-Al2O3活泼,当受到强热灼烧时,可以转化成α-Al2O3。γ-Al2O3有很大的表面积(200~600 m3·g-1,比同质量的活性炭表面积大2~4倍),所以有很强的吸附能力和催化活性,多用作吸附剂和催化剂。
2.氢氧化铝
Al(OH)3是典型的两性氢氧化物,其碱性略强于酸性。
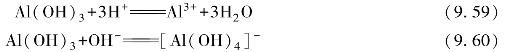
根据其具有的弱碱性,医药工业上用作抗胃酸药,以中和胃酸和保护胃部溃疡面。
3.铝盐
常见的铝盐有三氯化铝(AlCl3)、硫酸铝[Al(SO4)3]和硝酸铝[Al(NO3)3]等。铝盐极易水解,一些弱酸的铝盐在水中几乎完全水解。例如,向Al3+溶液中滴加Na2 CO3或Na2S溶液,都生成Al(OH)3沉淀,而不能得到Al2(CO3)3或Al2S3。
![]()
无水铝盐不能通过简单地将溶液加热进行蒸发浓缩的方法来制取,须用干法制得。例如,通过金属铝和氯气反应而得:(https://www.xing528.com)
![]()
或通过氧化铝的氯化制取:
![]()
若控制蒸发条件,抑制水解,设法使铝盐从水溶液中析出,也可制得固体的铝盐,不过它们都含有结晶水,如AlCl3·6H2O、Al2(SO4)3·18H2O、Al(NO3)3·6H2O等。
(1)卤化铝
因为Al3+有很强的极化能力,因此,在卤化铝中,除AlF3是离子型化合物外,AlCl3、AlBr3、AlI3都是共价型化合物。而且它们均为缺电子分子,都易形成双聚分子Al2 Cl6、Al2Br6、Al2I6。卤化铝中最主要的是AlCl3,其中的Al是缺电子原子,存在空轨道,Cl原子有孤电子对,因此可通过配位键形成具有桥式结构的气态双聚分子Al2Cl6,其结构如图9-3所示。
Al2Cl6分子有四个键和两个三中心四电子氯桥键。在800℃时,双聚分子完全分解为单分子,分子是平面三角形构型。
常温下,无水AlCl3是白色晶体,但常因为含有FeCl3而呈黄色,能溶于几乎所有的有机溶剂,在水中会发生强烈水解,甚至在空气中遇到水也会猛烈冒烟。应避免无水AlCl3接触皮肤,以免其水解释放出大量热而被灼伤。无水AlCl3最重要的工业用途是作为有机合成和石油化工的催化剂。
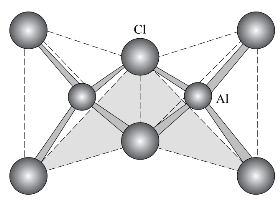
图9-3 Al2Cl6结构
(2)硫酸铝
无水硫酸铝为白色粉末,易溶于水,其水溶液因Al3+的水解而呈酸性,硫酸铝易与碱金属硫酸盐结合形成复盐。例如,KAl(SO4)2·12H2 O称为铝钾矾,俗称明矾。它们的组成可用通式MIMⅢ(SO4)2·12H2 O来表示,这类化合物称为矾。其中MI=Na+、K+、Rb+、Cs+,MⅢ=Al3+、Cr3+、Fe3+、Co3+、Ga3+、V3+。
硫酸铝与明矾是工业上重要的铝盐,由于它们能水解生成Al(OH)3胶状沉淀,具有很强的吸附性能,所以被用作净水剂以吸附水中的悬浮杂质,其水解产物均有吸附和凝聚作用。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




