B原子是周期表ⅢA族中唯一的非金属元素,其价电子构型是2s22p1。B原子的价电子少于价电子层数,是缺电子原子。与碳、硅相似,硼以形成共价型分子为特征。硼和硅在周期表中处于一条对角线上,它们的离子极化力接近,有许多性质相似。

图8-39 沸石的结构示意图
硼及其化合物结构上的复杂性和键型上的多样性,丰富和扩展了现有的共价键理论,因此,硼及其化合物的研究在无机化学发展中占有独特的地位。
1.硼单质
单质硼有多种复杂的晶体结构,但都是以B12的二十面体为基本结构单元,每个硼原子和5个硼原子相连,如图8-40所示。然后B12的这种二十面体间以不同的连接方式,不同的键型,形成不同类型的硼晶体。其中最普通的一种是α-菱形硼。

图8-40 硼单质(B12)
单质硼的晶体属于原子晶体,所以硼的熔点(2 300℃)、沸点(2 550℃)很高,硬度很大(在单质中仅次于金刚石)。化学性质也不活泼,但无定形硼和粉末状硼较活泼。无定形硼为棕色粉末,熔沸点高。
无定形硼在室温下与F2反应得BF3,高温时,除H2、Te、稀有气体外,能与所有非金属如O2、S、卤素、N2等化合,分别得到B2O3、B2S3、BX3、BN等。
B和O2的亲和力很强。
![]()
硼与水蒸气作用:
![]()
硼与氧化性酸作用:
![]()
B和O2的亲和力超过硅的,所以它能从许多稳定的氧化物(如Si2、P25等)中夺取氧,用作还原剂。
![]()
因此,硼在炼钢工业中用作去氧剂。
2.硼的化合物
(1)硼的氢化物
硼的氢化物的物理性质类似于烷烃,因此称为硼烷。多数硼烷组成是B n H n+4、B n H n+6,少数为B n H n+8、B n H n+10。硼有复杂的成键特征,但本节只介绍最简单的乙硼烷B2H6。BH3不存在是由于B的价层轨道没有被充分利用,且配位数未达到饱和,又不能形成稳定的sp2杂化态的离域大π键。
B2H6中共只有12个价电子,B原子采取sp3不等性杂化,2个B原子各与2个H原子形成4个B—Hσ键,这4个键在同一平面上。位于该平面上下且对称的H原子与硼原子分别形成垂直于上述平面的2个三中心二电子键,一个在平面上方,另一个在平面下方,每一个三中心二电子键是由1个H原子和2个B原子共用2个电子构成的,称为氢桥键,如图8-41所示。

图8-41 乙硼烷结构
B2H6是理想的火箭燃料,但有很强的毒性,储存条件苛刻,易燃且易水解。

在有机化学上,B2H6是万能还原剂。
![]()
另外,B2H6可以制备聚合物,高温稳定,低温保持黏度不变。硼烷化合物可与蛋白质结合,能用于肿瘤治疗。(https://www.xing528.com)
(2)硼的含氧化合物
硼是亲氧元素,有许多硼的含氧化合物,下面主要介绍三氧化二硼(B2O3)、硼酸(H3BO3)和硼砂(Na2B4O7·10H2O)等。
B2O3是白色固体,易溶于水,生成硼酸。由于硼与氧形成的B—O键键能大,因此B2O3较稳定。其结构如图8-42所示。熔融的B2O3可熔解许多金属氧化物,反应得到特征颜色,称为硼珠实验。硼珠实验可用于定性分析中,用来鉴定金属离子。
B2O3与NH3反应,在500℃生成(BN)n,与石墨、金刚石结构相似。

图8-42 三氧化二硼的空间结构
![]()
在H3BO3的晶体中,每个B原子以3个sp2杂化轨道与3个O原子结合成平面三角形结构,每个O原子除了以共价键与1个B原子和1个H原子相结合外,还通过氢键与另一个H3BO3单元中的H原子结合而连成片层结构,如图8-43所示,层与层之间则以微弱的范德华力相吸引。所以硼酸晶体是片状的,有解离性,有滑腻感,可作润滑剂。由于硼酸的缔合(氢键)结构,在冷水中溶解度小,在热水中因部分氢键断裂而使溶解度增大。

图8-43 硼酸层状结构(a)及缔合氢键(b)
H3BO3为一元弱酸,![]() =5.8×10-10,它的酸性并不是因为它本身给出质子,而是由于其是缺电子原子,它加合了来自水分子的OH-而释放出H+。
=5.8×10-10,它的酸性并不是因为它本身给出质子,而是由于其是缺电子原子,它加合了来自水分子的OH-而释放出H+。
利用硼酸的这种缺电子性质,加入多元醇(如甘油或甘露醇)生成稳定的配合物,可使硼酸的酸性增强。
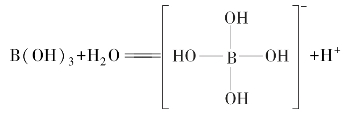
硼酸与碱反应:
![]()
常利用硼酸和甲醇或乙醇在浓硫酸存在的条件下,生成的挥发性硼酸酯燃烧所特有的绿色火焰来鉴别硼酸根。
![]()
硼酸被大量地用于玻璃和陶瓷工业。因为它是弱酸,对人体的受伤组织有缓和的防腐消毒作用,是医药上常用的消毒剂之一。硼酸也是减少排汗的收敛剂,为痱子粉的成分之一。此外,它还用于食物防腐。
硼砂(Na2B4O7·10H2O)是最重要的硼的含氧酸盐,是一种带有结晶水的四硼酸的钠盐。其四硼酸根离子[B4O5(OH)4]2-是由两个BO4四面体和两个BO3原子面通过共用顶角氧原子而连接成的,其键连关系如图8-44所示,所以硼砂的化学式可以写作Na2B4O5(OH)4·8H2O。硼砂晶体在空气中易失去水而风化。受热到400℃左右,将失去8个结晶水和2个羟基水,形成化学式为Na2B4O7的无水盐。基于这种结构单元的存在,硼砂的化学式经常写成Na2B4O7·10H2O。


图8-44 硼砂的酸根结构
硼砂是无色半透明的晶体或白色结晶粉末。在878℃融化为玻璃体,熔融态的硼砂也能溶解一些金属氧化物,并依金属的不同而显出特征的颜色(硼酸也有此性质)。因此,在分析化学中可以用硼砂做硼砂珠实验,以鉴定金属离子。例如:

硼砂除了鉴别金属外,还可以用来焊接金属,因为它可以消除金属表面的氧化物。硼砂是强碱弱酸盐,可溶于水,在水溶液中水解而显强碱性。
![]()
也可写成:
![]()
硼砂水解时得到等物质的量的酸和碱,所以这个水溶液具有缓冲作用,pH为9.23。常用于分析化学中的硼砂易于提纯,水溶液又显碱性,在实验室中常用它配制缓冲溶液或作为标定酸浓度的基准物质。
硼砂的水溶液由于水解而显强碱性,所以硼砂除了前面提过的用途以外,还是肥皂和洗衣粉的添料。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




