周期表中碳和硅是第ⅣA族非金属元素,硼是第ⅢA族非金属元素。
1.电子构型
C、Si价电子构型:ns2np2,价电子数=价电子轨道数,等电子原子。
B价电子构型:2s22p1,价电子数<价电子轨道数,缺电子原子。
2.成键特征
碳、硅、硼元素的电负性较大,要失去价电子层上的1~2个p电子成为正离子是困难的,它们倾向于将s电子激发到p轨道而形成较多的共价键,所以碳和硅的常见氧化态为+4,硼为+3。
碳原子不仅可以形成单键、双键、三键,碳原子之间还可以形成长的直链、支链和环形链等,纵横交错,变幻无穷。不仅碳原子间易形成多重键,而且能与其他元素如氮、磷、氧和硫形成多重键,构成了种类繁多的碳化合物。p-pπ键是碳的成键特征。如图8-30所示。
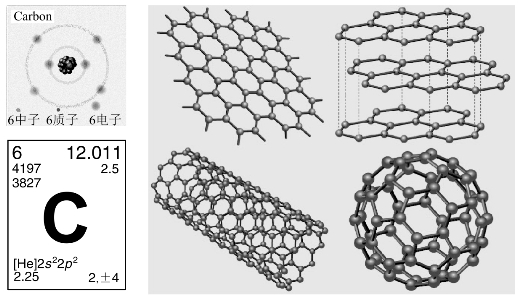
图8-30 碳元素及其单质
与碳原子不同,硅原子半径较大,不易形成p-pπ键,所以Si的sp和sp2态不稳定,很难形成多重键(双键或三键)。但可用3d价电子轨道,以sp3d2杂化形成配位数为6的σ键,如![]() 或与
或与![]() 类似,形成d-pπ配键,如
类似,形成d-pπ配键,如![]() 等。如图8-31所示,Si是亲O、亲F元素。(https://www.xing528.com)
等。如图8-31所示,Si是亲O、亲F元素。(https://www.xing528.com)
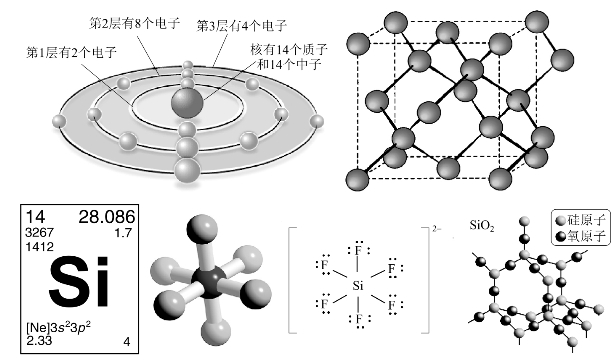
图8-31 硅单质及其化合物的结构
硼原子是缺电子原子,易形成多中心键。图8-32所示为硼单质。
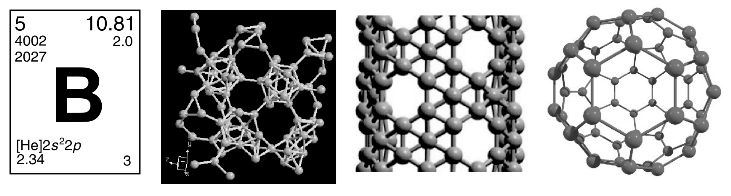
图8-32 硼元素及单质
3.自然存在
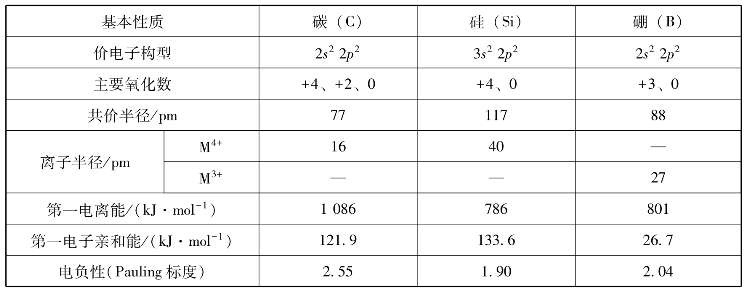
碳、硅、硼在地壳中的丰度分别为0.023%、29.50%和0.001 2%。碳的含量虽然不多,但在自然界中分布很广。大气中有CO2,矿物界有各种碳酸盐、金刚石、石墨和煤,还有石油和天然气等碳氢化合物。动植物体中的脂肪、蛋白质、淀粉和纤维素等也都是碳的化合物。硅的含量在所有元素中居第二位,地壳中含量最多的元素氧和硅结合形成的二氧化硅,占地壳总质量的87%。硅以大量的硅酸盐矿和石英矿存在于自然界。若碳是组成生物界的主要元素,那么,硅就是构成地球上的矿物的主要元素。硼在自然界中的含量很少,主要以硼酸盐形式的矿物存在,如硼砂、硼镁矿等。碳、硅、硼的基本性质见表8-11。
表8-11 碳、硅、硼的基本性质
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




