氮在自然界中以单质和化合物形式存在,在地壳中的含量为0.004 6%,在大气中以N2的形式存在,约占大气的78.1%(体积分数)。化合态的氮分布很广,氮在人体内的质量分数超过5%,是组成氨基酸和蛋白质等的主要元素,也是植物生长的必需元素;自然界最大的含氮矿源为智利硝石(NaNO3)矿。
1.氮的单质
氮气是无色无味的气体,微溶于水(在273 K和100 kPa下100 cm3水能溶解24 cm3氮气)。N2中因形成三键而键长(109.5 pm)很短,两个氮原子的px电子形成1个σ键后,py和pz电子又分别形成两个方向互相垂直的π键,如图8-16所示。N2在常温下很不活泼,不与O2、H2O、酸和碱等化学试剂反应。当T=3 000℃时,N2的解离度仅为0.1%,可认为不分解,但植物根瘤上生活的一些固氮细菌能够在常温常压下把空气中的N2变成氮化物。在放电条件下,N2与O2生成NO。
氮主要用于合成氨,以氨为原料可以制造硝酸、化肥和炸药等。由于在常温下具有化学惰性,因此氮气常被用来作保护气体,液氮可以作制冷剂。
2.氮的氢化物
氮的氢化物主要有氨(NH3)、联氨(N2H4)、羟胺(NH2OH)和叠氮酸(HN3)。本节主要介绍前三种化合物。
(1)氨和铵盐(-3氧化数)
在常温常压下,氨是具有刺激性气味的无色气体。NH3有较大的极性且分子间能形成氢键,所以其熔沸点高于同族的PH3。
氨极易溶于水,是在水中溶解度最大的气体之一。0℃时,1 dm3水能溶解1 200 dm3的氨,在20℃时,1 dm3水可溶解700 dm3氨。氨溶于水则为氨水,每1 cm3氨水的质量小于1 g,氨含量越高,氨水的密度越小。一般市售浓氨水每1 cm3的质量为0.91 g,含NH3的质量分数约28%。液氨是很好的强离子化溶剂,能溶解许多无机盐。
在氨分子中,氮采取不等性sp3杂化,有一对孤电子对、三个N—Hσ键,分子呈三角锥形结构。由于孤电子对对成键电子对的排斥作用,氨分子中N—H共价单键之间的键角变小至107°18′,这种结构使得NH3分子有较强的极性,其偶极矩为1.66D,也使得NH3有较强的配位能力。
NH3分子的结构特点和分子中N的氧化数决定了它的许多物理性质和化学性质。在一般情况下,氨很稳定。它能参加的化学反应可归纳成4类:配位反应,氨分子的孤电子对向其他反应物配位,有时称为加合反应;取代反应,NH3分子的氢可被其他基团取代;氨解反应,类似于水解反应;氧化反应,NH3中氮元素具有最低氧化数(-3),被氧化成较高氧化数。下面详细述之。
氨分子中的孤电子对与其他分子或离子成配位键,得到氨的配合物。例如,![]() 等。常利用生成氯的配合物使一些不溶于水的化合物溶解,如AgCl、Cu(OH)2、Zn(OH)2等能溶解在氨水中。
等。常利用生成氯的配合物使一些不溶于水的化合物溶解,如AgCl、Cu(OH)2、Zn(OH)2等能溶解在氨水中。
氨中的三个氢可依次被取代,生成相应的氨基、亚氨基和氮化物等衍生物。例如,氨与金属钠的反应,得到白色氨基钠固体,Na取代了NH3的一个H原子。
图8-16 氮气的三键
![]()
在加热条件下氨与金属反应生成氮化物:
![]()
铵盐与氯气反应生成三氯化氮:
![]()
与水类似,液氨可自偶解离:
![]()
氨解反应与水解反应类似:
在NH3和![]() 中,N处于最低氧化数(-3),在一定条件下能失去电子而被氧化。例如,在纯氧中氨燃烧:
中,N处于最低氧化数(-3),在一定条件下能失去电子而被氧化。例如,在纯氧中氨燃烧:
![]()
在铂催化剂的作用下,氨可被氧化成氧化亚氮:
![]()
氯或溴也能在气态或溶液中把氨氧化,氨也可被HNO2氧化:
氨与酸可以形成相应的铵盐。铵盐中酸根的酸性越强,铵盐的稳定性越强,因为铵离子半径为143 pm,与钾离子(133 pm)和铷离子(147 pm)的半径相近。因此,铵盐的性质与碱金属盐类的相似。
铵盐一般是无色易溶于水的晶体,在水中都有一定程度的水解。
![]()
铵盐受热容易分解,分解产物与阴离子对应的酸的挥发性、氧化性以及分解温度有关。一般情况可分为以下几种情况:若是不挥发性非氧化性酸的铵盐,分解生成NH3和酸式盐或者酸;若是挥发性非氧化性酸的铵盐,分解生成NH3和相应的酸;若是强氧化性酸的铵盐,分解生成N2或氮的氧化物。
NH4Cl可除去金属表面的氧化物,所以NH4Cl称为硇砂。
![]()
在含有![]() 的溶液中加入强碱可以生成能使红色石蕊试纸变蓝的NH3,这是检验
的溶液中加入强碱可以生成能使红色石蕊试纸变蓝的NH3,这是检验![]() 的常用方法。
的常用方法。
用奈斯勒(Nessler)试剂可以进行定量检验,奈斯勒试剂是碱性四碘合汞(Ⅱ)酸钾溶液,即K2HgI4的KOH溶液,能与![]() 生成红棕色沉淀,反应为
生成红棕色沉淀,反应为
(2)联氨(-2氧化数)
与氮和氧形成过氧化物类似,氮也可形成过氮化物,最简单的过氮化物为N2H4,称为联氨或肼。N2H4也可以看成NH3内的一个H被—NH2取代的衍生物,N上仍有孤电子对。
联氨分子的极性很大,偶极距μ=1.85D,说明它是顺式结构。N—N键长为144.9 pm,N—H键长为102.1 pm,∠HNH为108°,∠NNH为112°,扭转角为90°~95°,沿N—N键轴方向观察,如图8-17所示。
图8-17 联氨分子结构
联氨的水溶液显弱碱性,是二元弱碱,显碱性的机理与NH3的相同。联氨碱性弱于氨的,这是因为N上的孤电子对受到NH2基团吸引力大,所以比氨更难给出电子对。
过渡金属离子的存在会加速N2H4的分解。
为增加其稳定性,加明胶可以吸附或螯合金属离子,也可制成相应的盐类,如硫酸盐(N2H4·H2SO4)、盐酸盐(N2H4·2HCl)等。
N2H4的氧化数为-2,处于中间价态,既有氧化性,又有还原性。
酸中![]()
碱中![]()
联氨无论在酸中还是碱中作氧化剂,由于动力学原因,其反应速率都非常小,以至于无实际意义,因此只是一个强还原剂,特别是在碱性介质中。
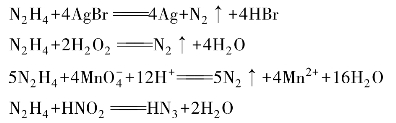
联氨与空气混合可燃烧并放出大量的热,(CH3)2NNH2(偏二甲肼)可作为火箭燃料。
![]()
联氨是一种应用广泛的化工原料,具有很高的燃烧热,可用作火箭和燃料电池的燃料。由于联氨分子有2个亲核的氮和4个可供置换的氢,可以合成各种衍生物,其中包括塑料发泡剂、抗氧剂、各种聚合物、聚合物交联剂和链延长剂、农药、除草剂和药品等。
(3)羟氨(-1氧化数)
羟氨可看成NH3内的一个H被—OH取代的衍生物,N上仍有孤电子对可以配位。羟氨分子中的N和O都是以不等性sp3杂化轨道形成σ键。羟氨分子的结构如图8-18所示。
羟氨是白色固体,不稳定,在15℃左右发生热分解,反应方程式为:
![]()
其水溶液及其盐如羟氨硫酸盐(NH2OH)2·H2SO4较稳定。
羟氨是一元弱碱,显碱性的机理与NH3的相同。碱性弱于氨和联氨,其原因是N上的孤电子对受到OH基团吸引力更大,所以比氨和联氨更难给出电子对。
![]()
羟氨和联氨一样,既有氧化性,又有还原性,但以还原性为主。
![]()
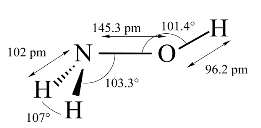
图8-18 羟氨分子结构
羟氨在酸中、碱中均是还原剂,特别是在碱性介质中是强还原剂,可使银盐、卤素还原,本身则被氧化为N2、N2O、NO等气体产物脱离体系,不会给反应体系带来杂质,因此常用于有机反应中。
3.氮的氧化物
氮的氧化物有多种,包括N的氧化态从+1到+5的一系列氧化物,如N2O、NO、N2O3和N2O5。氮的氧化物中除N2O(笑气)的毒性较小外,其他都有毒性。工业尾气和汽车尾气中含有各种氮的氧化物(主要是NO和NO2,以NO x表示),NO x能破坏臭氧层,产生光化学烟雾,是造成大气污染的原因之一。目前处理废气中NO x的方法之一是用Cr2O3作催化剂,通入适量的NH3将其还原为氮。
![]()
在氮的氧化物中,以NO和NO2较为重要。下面着重介绍NO和NO2。其结构如图8-19所示。
(1)氧化亚氮的性质
NO呈无色气体,但在固态或液态时呈蓝色。NO是奇电子分子,有顺磁性。NO分子内有孤电子对,易与很多金属形成配合物,其结构如图8-19所示。例如,NO与FeSO4溶液形成棕色可溶性的硫酸亚硝酰合铁(Ⅱ)配合物。
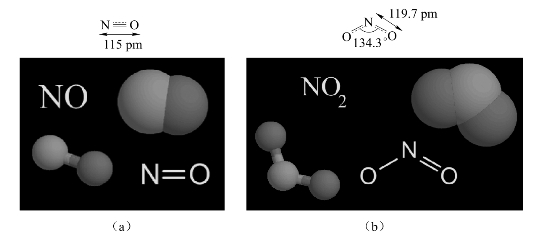
图8-19 NO(a)和NO2(b)的分子结构
![]()
NO不助燃,微溶于水,但不与水反应,也不与酸、碱反应,在大气中极易与氧发生反应生成红棕色的二氧化氮。
氧化亚氮是人体最有效的血管扩张剂,是机体内一种应用广泛而性质独特的信号分子,尤其是在心脑血管调节、神经细胞间的信息交流与传递、血压恒定的维持、免疫体系的宿主防御反应中等方面,都起着十分重要的作用。如果人体不能制造出足够的NO,会导致一系列严重的疾病,如高血压、血凝失常、免疫功能损伤、神经化学失衡、性功能障碍以及精神痛苦等。(https://www.xing528.com)
伊格纳罗(L.J.Ignarm)等三位美国科学家成功发现NO是一种可以传递信息的气体,它可以通过细胞薄膜,去调节另一细胞的功能。他们的发现开创了生物体系信息传递的新理论。正是这一重大发现和对NO的研究,使他们获得1998年诺贝尔医学奖。
(2)二氧化氮的分子结构与性质
NO2分子为V形结构,键角为134.25°,键长为119.7 pm。分子内中心N原子采取sp2等性杂化,形成两个σ键,另一个单电子处于N的一个sp2杂化轨道上,剩余pz轨道形成![]() 离域π键。从图8-20可见NO2也是奇电子分子,有顺磁性,是棕红色气体,易聚合成抗磁性、无色的二聚体N2O4。
离域π键。从图8-20可见NO2也是奇电子分子,有顺磁性,是棕红色气体,易聚合成抗磁性、无色的二聚体N2O4。
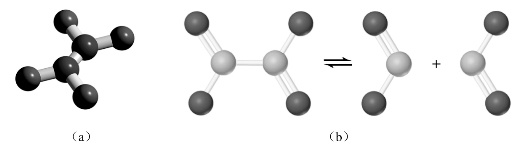
图8-20 NO2和N2 O4
(a)N2O4;(b)NO2与N2O4的可逆反应
![]()
键角∠ONO=134°和未成对电子占据杂化轨道使NO2容易发生二聚作用,都证实了N采取sp2等性杂化和形成![]()
NO2溶于水,并歧化成HNO3和HNO2,因此,NO2为混合酸酐。
![]()
HNO2不稳定,受热立即分解:
![]()
NO2溶于热水的总反应式为:
![]()
(3)亚硝酸及其盐
亚硝酸有顺式和反式两种结构。红外光谱数据表明,室温下反式比顺式更稳定。如图8-21所示。
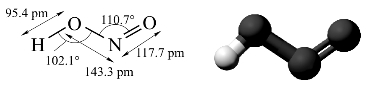
图8-21 亚硝酸分子结构
亚硝酸根NO与O3为等电子体,结构相似,为V形结构。![]() 中N原子以sp2不等性杂化轨道与氧原子的p轨道形成两个σ键,并且还有一个离域的
中N原子以sp2不等性杂化轨道与氧原子的p轨道形成两个σ键,并且还有一个离域的![]() 键,如图8-22所示。在
键,如图8-22所示。在![]() 中,∠ONO=115.4°,键角小于正常的120°,是由于孤电子对的作用。
中,∠ONO=115.4°,键角小于正常的120°,是由于孤电子对的作用。
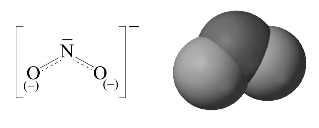
图8-22 亚硝酸根结构
亚硝酸(HNO2)是一种弱酸![]() ,酸性略强于乙酸。亚硝酸只能存在于稀冷的溶液中,温度稍高(室温)或浓度稍大,则易发生歧化分解。
,酸性略强于乙酸。亚硝酸只能存在于稀冷的溶液中,温度稍高(室温)或浓度稍大,则易发生歧化分解。
在碱性溶液中,![]() 不发生歧化,可以稳定存在。
不发生歧化,可以稳定存在。
亚硝酸盐特别是碱金属和碱土金属的亚硝酸盐都有很高的热稳定性。KNO2和NaNO2大量用于染料工业和有机合成工业中。除了浅黄色的不溶盐AgNO2,一般亚硝酸盐易溶于水。亚硝酸盐均有毒,易转化为致癌物质亚硝胺。
在亚硝酸和亚硝酸盐中,氮原子的氧化数为+3,处于中间氧化态,既有氧化性又有还原性。在酸性溶液中,![]() 所以HNO2氧化性较强,其还原产物最常见的是NO。例如
所以HNO2氧化性较强,其还原产物最常见的是NO。例如
![]()
这个反应可以定量地进行,能用于测定亚硝酸盐的含量。
在稀溶液中,![]() 的氧化性比
的氧化性比![]() 的强。例如
的强。例如![]() 在稀溶液中可氧化I-,但
在稀溶液中可氧化I-,但![]() 不能氧化I-,这是由动力学原因所致。亚硝酸和稀硝酸可以据此加以鉴别。
不能氧化I-,这是由动力学原因所致。亚硝酸和稀硝酸可以据此加以鉴别。
请注意,HNO2及其盐的氧化还原性不仅和溶液的酸碱性有关,还和与它反应的氧化剂或还原剂的相对强弱有关。在酸性溶液中,当遇到更强的氧化剂时,HNO2、![]() 作还原剂,
作还原剂,![]() 其氧化产物总是
其氧化产物总是![]()
![]()
 是两可配体,可以分别以N或O原子参与配位,以N原子配位
是两可配体,可以分别以N或O原子参与配位,以N原子配位![]() 称为硝基配合物,以O原子配位(M←ONO—)称为亚硝酸根配合物。例如,在弱酸性条件下Co2+与
称为硝基配合物,以O原子配位(M←ONO—)称为亚硝酸根配合物。例如,在弱酸性条件下Co2+与![]() 反应,首先Co2+被
反应,首先Co2+被![]() 氧化为Co3+,后者再与
氧化为Co3+,后者再与![]() 作用生成亚硝基配离子[Co(NO2)6]3-。
作用生成亚硝基配离子[Co(NO2)6]3-。
![]()
此反应可用来检验K+、Co2+或![]()
碱金属和碱土金属的亚硝酸盐都有很高的热稳定性。
KNO2和NaNO2大量用于染料工业和有机合成工业中。除了浅黄色的不溶盐AgNO2外,一般亚硝酸盐易溶于水。亚硝酸盐均有毒,易转化为致癌物质亚硝胺。
(4)硝酸及其盐
硝酸分子具有平面结构,其中心N原子采取sp2杂化,它的未杂化p轨道上的一对电子和两个氧原子的成单p电子形成一个离域的![]() 键,如图8-23所示。键角∠HON=102.2°,由两个端氧形成的键角∠ONO=130.27°,硝酸中H—O键长为96 pm,N—O(端)键长为119.9 pm,N—O(羟基)键长为140.6 pm,有分子内氢键。
键,如图8-23所示。键角∠HON=102.2°,由两个端氧形成的键角∠ONO=130.27°,硝酸中H—O键长为96 pm,N—O(端)键长为119.9 pm,N—O(羟基)键长为140.6 pm,有分子内氢键。
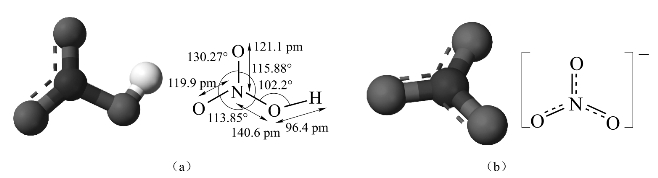
图8-23 硝酸(a)和硝酸根离子(b)结构图
硝酸根离子为正三角形结构,有3个N—Oσ键,键长为121 pm,有1个![]() 键。离子的对称性高,因而硝酸盐在正常状况下是稳定的。
键。离子的对称性高,因而硝酸盐在正常状况下是稳定的。
纯硝酸是无色液体,沸点为83℃,是具有挥发性的强酸,可以任何比例与水互溶。市售浓硝酸是恒沸溶液,含HNO3的质量分数为68%,沸点为394.8 K,密度为1.42 g·cm-3,物质的量浓度约为16 mol·dm-3。
硝酸具有不稳定性、强氧化性、硝化作用三大化学特性,这里只介绍前两项。浓硝酸受热或见光就会逐渐分解,使溶液呈黄色。
![]()
常用的浓HNO3因溶解了过多NO2而呈棕黄色,称为发烟硝酸,反应活性比硝酸的更强。
由于硝酸分子中的氮处于最高氧化态,以及硝酸分子的不稳定性,决定其具有强氧化性,它几乎可以氧化所有的单质(除氯、氧、稀有气体和Au、Pt、Ir等贵金属外)。硝酸浓度越大,其氧化性越强(发烟硝酸的氧化性比纯硝酸的还强),而且硝酸自身可被还原成一系列低氧化态的氮的化合物,例如:
![]()
具体以何种产物为主,不仅与硝酸本身的浓度有关,还取决于还原剂的本性和温度。
浓硝酸和非金属反应还原产物多数为NO。例如:
浓硝酸和金属(包括活泼金属和不活泼金属)反应,均以NO2为主要产物。例如:
![]()
稀硝酸与不活泼金属反应,以NO为主要产物。例如:
![]()
较稀硝酸与较活泼金属反应,以N2O为主要产物。例如:
![]()
很稀硝酸与活泼金属反应,产物为铵盐。例如:
![]()
可见稀硝酸与还原剂反应,产物多为NO。HNO3越稀,还原产物的氧化数越低;金属越活泼,还原产物的氧化数越低。
氧化能力强的氧化剂,本身被还原的程度(指氧化数下降的程度)不一定就大,因为含氧酸的氧化能力和本身被还原的程度是两个不同的概念。当硝酸与同一种金属反应时,其主要产物不同,主要是由于体系内存在以下平衡:
![]()
当HNO3浓度大时,平衡左移,产物以NO2为主;反之,体系中水含量多(一定范围内),平衡右移,产物以NO为主。
某些金属如Fe、Cr、Al等能溶于稀硝酸,但不溶于冷、浓HNO3,这是因为这类金属表面被浓硝酸氧化形成一层十分致密的氧化膜,阻止了内部金属与硝酸进一步作用,即钝化现象。经浓硝酸处理后的钝态金属就不易再与稀酸作用。
尽管浓硝酸具有很强的氧化性,但Au、Pt等金属在浓硝酸中仍然很稳定,它们可溶于王水中。
浓盐酸和浓硝酸的体积比约为3∶1的混合溶液称为王水。王水能溶解许多不溶于硝酸的金属,如金和铂等。
王水能够溶解金和铂的原因主要是,大量Cl-的存在能够形成稳定的配离子AuCl-4和![]() 使溶液中金属离子浓度减小,电对
使溶液中金属离子浓度减小,电对![]() 和
和![]() 的标准电极电势值比电对Au3+/Au和Pt4+/Pt低得多,所以,反应的结果更倾向于生成稳定的配离子,而不是相应的盐。这是Au的两种还原反应竞争的结果。相关的电极电势为
的标准电极电势值比电对Au3+/Au和Pt4+/Pt低得多,所以,反应的结果更倾向于生成稳定的配离子,而不是相应的盐。这是Au的两种还原反应竞争的结果。相关的电极电势为
![]()
可见,王水能溶解Au和Pt的主要原因不是王水的氧化能力比浓硝酸的强,而是Cl-的配位使金属的还原能力增强起决定性作用。总之,王水是具有酸、氧化剂、配合剂(Cl-)的三效试剂,而Cl-的配位起了决定性的影响。
硝酸盐大多数都是无色、易溶于水的晶体,其水溶液没有氧化性。硝酸盐的重要性质就是它的热稳定性,固体硝酸盐常温时较稳定,高温时受热迅速分解,分解产物与硝酸盐中相应的金属阳离子的性质有关。碱金属、部分碱土金属(比Mg活泼性强的金属)硝酸盐的分解产物多为亚硝酸盐。例如:
![]()
在Mg和Cu之间的金属硝酸盐,因其亚硝酸盐也不稳定,受热继续分解,生成金属氧化物、NO2和O2。例如:
![]()
在Cu以后的金属,因其亚硝酸盐和氧化物都不稳定,受热继续分解,生成金属单质、NO2和O2。例如:
![]()
上述硝酸盐热分解的一般规律与金属离子的价电子构型有关,可用离子极化观点加以解释。硝酸盐受热分解均有氧气放出,可助燃。无水固体硝酸盐都是强氧化剂,可用于熔矿、配制火药及各种焰火等。
请注意,含有结晶水的硝酸盐受热时,HNO3首先挥发,使体系酸度降低,部分盐水解,形成碱式盐。
![]()
利用亚硝酸盐有还原性而硝酸盐没有还原性这一性质可以鉴别二者。亚硝酸盐与浓硝酸作用有NO2生成,而硝酸盐与浓硝酸作用无NO2生成。最为著名的鉴别方法是棕色环实验。
在试管中加入硝酸盐与硫酸亚铁混合溶液,再缓慢沿着试管壁倒入浓硫酸,在浓硫酸与水溶液的界面有棕色的Fe(NO)2+生成,从试管的侧面可观察到棕色环;用亚硝酸盐代替硝酸盐进行实验,得到棕色溶液而观察不到棕色环。相关的反应为:
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




