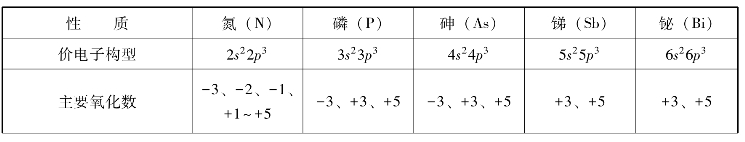
氮族是位于p区正中间的第ⅤA族元素,其性质呈现强的递变规律。N、P是典型的非金属元素,Sb和Bi为金属元素,As是介于非金属和金属之间的准金属元素,从上到下呈现出典型非金属-半金属-金属的一个完整过渡。这一点与ⅥA、ⅦA族不同。氮族元素的基本性质见表8-9。
表8-9 氮族元素的基本性质
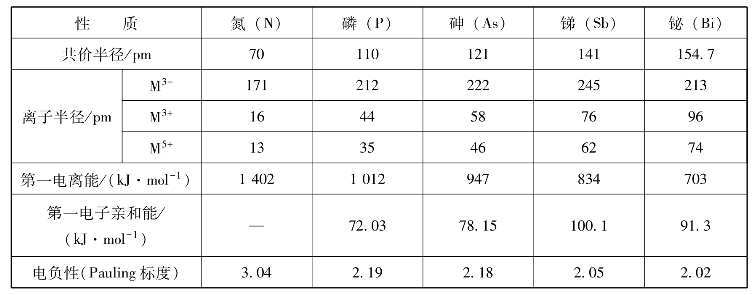
续表
 (https://www.xing528.com)
(https://www.xing528.com)
如图8-15所示,氮族元素价电子构型为ns2np3,有5个价电子,价层p轨道处于较为稳定的半充满状态。所以本族元素在成键时表现出既不容易失去电子形成+3价离子,也不容易得到电子形成-3价离子,而是容易通过共用电子对形成较稳定的共价键的特征,主要氧化数有-3、+3、+5。
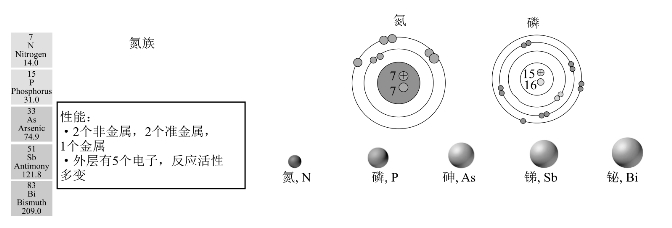
图8-15 氮族元素
自上而下氧化数为+3的物质稳定性增加,而+5氧化态的物质稳定性降低。这是因为自上而下过渡到铋时,由于铋原子半径较大,成键时电子云重叠程度较小,铋原子出现了4f和5d能级,而f、d电子对原子核的屏蔽作用较小,6s电子又具有较大的钻穿作用,所以6s能级显著降低,从而使6s电子成为惰性电子对而不易参与成键,铋常显+3价。这种自上而下低氧化态比高氧化态物质稳定的现象,称为惰性电子对效应。本节主要介绍与含能材料相关的氮和磷元素及其化合物。
N和P是典型的非金属,原子的价电子构型类似,但性质上有很大差别。其原因是N价层没有d轨道,2s电子不能向d轨道跃迁,最多形成3个共价键、1个配位键(N的孤电子对),所以N原子的配位数不超过4。而P原子的最外电子层有空的d轨道,这些d轨道也可能参与成键,P原子的最高配位数可达到6,如在PCl5中存在![]() ,其中P的杂化轨道为sp3d2。还有P除了能形成σ配键外,还有空的3d空轨道,可以接受过渡金属反馈回来的电子对,形成反馈π键,所以配位能力更强。
,其中P的杂化轨道为sp3d2。还有P除了能形成σ配键外,还有空的3d空轨道,可以接受过渡金属反馈回来的电子对,形成反馈π键,所以配位能力更强。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




