1.单质硫
(1)单质硫的同素异形体
晶体硫有环状和链状两种情况。环状以S8环最稳定,呈环状或皇冠状。S8环又能以不同的晶形生成几种同素异形体,其中最常见的是斜方硫和单斜硫。
斜方硫呈黄色,单斜硫呈浅黄色,它们均能溶于CS2、C6H6等非极性溶剂,而链状硫则不溶。S4、S8、S12分子的形状如图8-9所示。
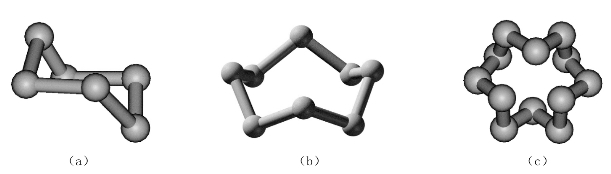
图8-9 几种单质硫结构
(a)S4;(b)S8;(c)S12
硫单质加热至160℃以后,环状的硫分子开始断裂形成链状的线形分子,只有当温度高于1 727℃以后,才开始有单原子的硫分子出现。
(2)单质硫的化学性质
硫和绝大部分金属与非金属都能直接化合。

![]()
当硫遇到强氧化性的物质时,作还原剂。例如,硫与浓硝酸或浓硫酸作用,被氧化为硫酸或二氧化硫。

硫在沸腾的碱液中发生歧化反应。
![]()
硫在工业中很重要,它为生产橡胶制品的重要原料;可用来杀真菌;用作化肥;用于制造黑色火药、焰火、火柴等;作为原料制造某些农药(如石灰硫黄合剂);医疗上,还可用来制硫黄软膏医治某些皮肤病等。
2.硫化氢、硫化物和多硫化物
(1)硫化氢
硫化氢是一种无色、有毒、有臭鸡蛋气味的气体,空气中含有体积分数为0.1%的H2S会迅速引起头疼、晕眩等症状,吸入大量H2S会造成昏迷甚至死亡。经常与H2S接触会引起嗅觉迟钝、消瘦、头痛等慢性中毒。使用H2S气体时,必须在通风橱中操作。空气中H2S的允许含量不得超过0.01 mg·dm-3。
硫化氢在213 K时凝聚成液体,187 K时凝固。H2S在水中的溶解度较小,其水溶液称为氢硫酸。在25℃、101.325 kPa条件下,饱和溶液中H2S的浓度约为0.1 mol·dm-3。
H2S的水溶液是二元弱酸,在水中分两步解离:
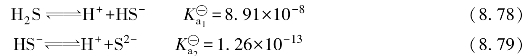
在H2S中,硫处于最低氧化态-2,所以硫化氢的一个重要化学性质是具有还原性。
![]() 可见,无论是在酸性还是在碱性溶液中,H2S都具有较强的还原性。
可见,无论是在酸性还是在碱性溶液中,H2S都具有较强的还原性。
H2S能在空气中燃烧生成二氧化硫和水,若空气不足,则生成单质硫和水。
![]()
H2S水溶液暴露在空气中易被氧化析出游离硫,而使溶液变浑浊。
![]()
因此,实验室中使用的H2S的水溶液必须现用现配,否则,会被氧化而失效。
单质碘和Fe3+也能将H2S氧化而析出硫。更强的氧化剂(如单质Br2、Cl2)可以把H2S氧化成硫酸。
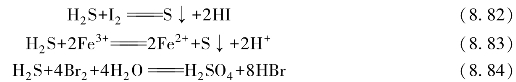
在工业上,常用硫铁矿或硫化物与无氧化性酸反应制备H2S。在实验室中,是由金属硫化物同酸作用来制备的。
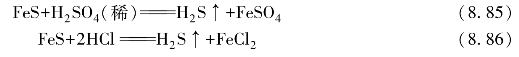
若用稀H2SO4,产物中含有少量SO2和H2(因为合成的FeS中含有少量的Fe);若用HCl,则生成的H2S气体中含有少量HCl气体。
硫化氢气体具有毒性和臭味,实验时常用新配制的H2S饱和水溶液或硫代乙酰胺作为代用品,可以减少有毒H2S气体逸出,降低实验室中空气的污染程度。硫化氢的水溶液可由硫代乙酰胺水解得到。在酸性溶液中,硫代乙酰胺水解生成H2S,可代替H2S。水解反应为:
![]()
长时间煮沸,CH3CONH2进一步水解:
![]()
在碱性溶液中,硫代乙酰胺水解生成S2-,可以代替Na2S使用。水解反应为:
![]()
在氨溶液中,硫代乙酰胺水解生成HS-,可以代替(NH4)2S使用。水解反应为:
![]()
硫代乙酰胺的水解速率随温度升高而增大,反应一般在沸水浴中进行。在碱性溶液中,其水解速率较在酸性溶液中的大。
(2)硫化物
在硫化物中,非金属硫化物并不多,而金属硫化物可看成氢硫酸盐。因为氢硫酸是二元酸,可形成酸式盐和正盐,正盐即硫化物。酸式盐都易溶于水。除了碱金属和碱土金属的硫化物,金属硫化物大多难溶于水,但硫化物之间溶解度不尽相同,并具有特征的颜色,因此,在分析化学中常用H2S体系分析法分离金属离子。
轻金属硫化物包括碱金属、碱土金属(除Be外)、铝及铵离子的硫化物。碱金属(包括![]() )的硫化物和BaS易溶于水,由于水解而使溶液呈碱性,所以碱金属硫化物俗称硫化碱。例如:
)的硫化物和BaS易溶于水,由于水解而使溶液呈碱性,所以碱金属硫化物俗称硫化碱。例如:
![]()
碱土金属硫化物溶于水(BeS难溶),也发生水解作用。例如
![]()
所生成的酸式硫化物可溶于水。若将溶液煮沸,水解可进行完全。
![]()
由于氢硫酸是弱酸,因此,所有硫化物在水溶液中均发生不同程度的水解作用。例如0.10 mol·dm-3溶液的水解度为94%;Al2S3完全水解为Al(OH)3和H2S;即使是难溶硫化物(如PbS),其溶解的部分也明显水解。
重金属硫化物一般都难溶于水并且具有特征颜色。Al2S3和ZnS为白色,MnS为浅粉色,As2S3和As2S5为浅黄色,SnS2和CdS为黄色,Sb2S3和Sb2S5为橙色,SnS为灰褐色,Bi2S3为暗棕色,HgS为黑色或红色,其余均为黑色。
硫化物的组成、性质均和相应氧化物的相似。只是硫化物的碱性弱于相应氧化物的。例如
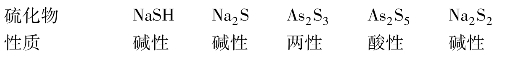
![]()
同周期元素最高氧化态硫化物从左到右酸性增强,如第五周期的Sb2S5的酸性强于SnS2的。同族元素相同氧化态的硫化物从上到下酸性减弱,碱性增强,如As2S5的酸性强于Sb2S5的,Sb2S3为两性,Bi2S3为碱性。在同种元素硫化物中,高氧化态硫化物的酸性强于低氧化态硫化物的酸性,如As2S5、Sb2S3的酸性分别强于As2S3、Sb2S3的。
酸性硫化物可溶于碱性硫化物,如As2S3、As2S5、Sb2S3、Sb2S5、SnS2、HgS等酸性或两性硫化物可与Na2S反应。
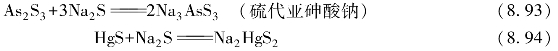
在可溶性硫化物的浓溶液中加入硫粉,硫溶解而生成相应的多硫化物,就好像碘化钾溶液可以溶解单质碘一样。

碱金属多硫化物M2S x(x=2~6,个别x可高达9)溶液的颜色可随着溶解的硫的增多而由无色变为黄色、橙黄色,最深为红色。实验室中的Na2S溶液放置时颜色会越来越深,就是因为Na2S易被空气氧化,产生的S溶于Na2S生成Na2S x(多硫化物)。
当多硫化物M2S x中的x=2时,如Na2S2或(NH4)2S2,称为过硫化物。过硫化物实际上是过氧化物的同类化合物。因此,过硫化物与过氧化物相似,也具有氧化性,但其氧化性弱于过氧化物的。
多硫化物能氧化As(Ⅲ)、Sb(Ⅲ)、Sn(Ⅱ)的硫化物,或把这些金属的硫代亚酸盐氧化为硫代酸盐。
![]()
SnS显碱性,不溶于Na2S中,但可溶于多硫化物中。
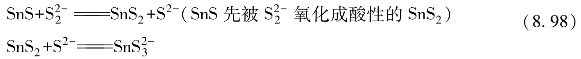
在酸性溶液中很不稳定,易歧化分解生成单质S和H2S。
![]()
Na2S、(NH4)2S遇酸发生浑浊,就是因为其中所含多硫化物发生了上述反应。
多硫化物是分析化学常用试剂,Na2S2在制革工业中用作原皮的脱毛剂,硫酸工业的重要原料黄铁矿FeS2是多硫化物的一种。在农业上用作杀虫剂的石灰硫是四硫化钙CaS4。
3.硫(Ⅳ)的含氧化合物
硫的氧化物有S2O、SO、S2O3、SO2、SO3、S2O7、SO4,其中较重要的是SO2和SO3。硫的含氧酸有H2SO3、H2SO4、H2S2O7、H2S2O3、H2S4O6、H2SO5、H2S2O8和H2S2O4等,其中较重要的是H2SO3、H2SO4、H2S2O3和H2S2O8。
(1)二氧化硫的结构和性质
SO2分子呈V形结构,其成键方式与O3的类似,S原子sp2杂化,S原子和两个配位O原子除了以σ键结合外,还形成一个三中心四电子的大π键![]() 如图8-10所示。
如图8-10所示。

图8-10 二氧化硫分子结构
![]()
SO2又称亚硫酸酐,是一种有强烈刺激性和恶臭的无色气体,是空气中的污染物之一。SO2是极性分子,易溶于水,其水合物是亚硫酸(H2SO3)。SO2较易液化,在常压下263 K就能液化。液态SO2是一种良好的非水溶剂。以液态SO2作溶剂时,它既不放出质子,也不接受质子,这是它与水不同的地方。
在SO2分子中,硫的氧化数为+4,介于-2与+6之间,所以SO2既有氧化性,又有还原性,但以还原性为主,只有遇到强还原剂时,才表现出氧化性。反应式(8.100)~(8.102)表现了二氧化硫的还原性。

SO2遇见更强的还原剂时,也能表现氧化性。例如:
![]()
此反应在气态时也能进行,可认为是火山产生天然硫的原因。
![]()
这是从烟道气中分离、回收硫的一种方法。SO2能和一些有机色素结合成无色有机化合物。例如,品红溶液通入SO2立即变为无色,因此可用作纸张、草编制品等的漂白剂。SO2的漂白作用不同于漂白粉的氧化漂白作用。SO2可作配体,以不同的方式与过渡金属形成配合物。
(2)SO2的制备
以下反应是采用还原法从高价到+4价:

工业上经常采用氧化法制备二氧化硫。从低价到+4价,如硫(如硫矿)和硫化物(如黄铁矿)的燃烧。

实验室中则采用置换法来制备SO2。
二氧化硫主要用于生产硫酸和亚硫酸盐,也用作消毒剂和防腐剂,还可用作漂白剂等。SO2也是一种大气污染物。在高空中,二氧化硫与空气中的氧及水蒸气发生化学反应形成硫酸,硫酸含在雨水中即形成“空气杀手”——酸雨。酸雨同二氧化硫一样加速了桥梁等建筑物的腐蚀速率。但是,它的最危险的影响是逐步降低了水和土壤的pH,导致生态体系的显著改变。SO2的职业性慢性中毒会引起丧失食欲、大便不通和气管炎症。空气中SO2含量不得超过0.02 mg·dm-3。
(3)亚硫酸及其盐
二氧化硫溶于水,生成很不稳定的亚硫酸,H2SO3只存在于水溶液中(光谱证明),从来也没有得到过游离的纯H2SO3。SO2在水中主要是物理溶解,SO2分子与H2O分子之间的作用是较弱的,因此,亚硫酸可写成SO2·x H2O。市售亚硫酸试剂中SO2量不少于6%。
SO2是二元中强酸,H2SO3在水溶液中存在下列解离平衡:
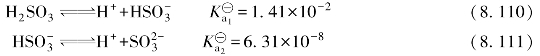
可见,H2SO3是二元中强酸,可形成正盐和酸式盐两种类型,如Na2O3和NaHSO3。除碱金属及铵的亚硫酸盐极易溶于水外,其他金属的亚硫酸盐均难(或微)溶于水,但都能溶于强酸。亚硫酸氢盐的溶解度大于相应正盐的溶解度。
亚硫酸及其盐的不稳定性从元素电势图可见,![]() ,亚硫酸及其盐无论是在酸性还是在碱性溶液中均可歧化分解。
,亚硫酸及其盐无论是在酸性还是在碱性溶液中均可歧化分解。

亚硫酸盐或亚硫酸氢盐遇到强酸即可分解放出SO2,这是实验室制取少量SO2的方法。

(4)亚硫酸及其盐的氧化还原性
在亚硫酸及其盐中,硫的氧化数是+4,居中间氧化态,所以亚硫酸及其盐既有氧化性又有还原性,从硫的元素电势图看,![]() 值较小(或为负值),说明S(Ⅳ)的还原性是主要的。例如,亚硫醇及其盐的溶液能使I2还原为I-,Br2、Cl2被还原为Br-、Cl-。亚硫盐比亚硫酸具有更强的还原性。Na2SO3在溶液和空气中均易被氧化成Na2SO4,因此亚硫酸盐常被用作还原剂。例如
值较小(或为负值),说明S(Ⅳ)的还原性是主要的。例如,亚硫醇及其盐的溶液能使I2还原为I-,Br2、Cl2被还原为Br-、Cl-。亚硫盐比亚硫酸具有更强的还原性。Na2SO3在溶液和空气中均易被氧化成Na2SO4,因此亚硫酸盐常被用作还原剂。例如
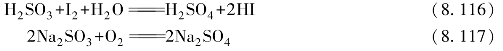
亚硫酸及其盐只有遇到更强的还原剂时,才表现出氧化性。例如
![]()
亚硫酸盐有很多实际用途,如Ca(HSO3)2大量用于造纸工业,用它溶解木质素来制造纸浆。Na2SO3和NaHSO3大量用于染料工业,用作漂白织物时的去氯剂。例如:
![]()
另外,农业上使用NaHSO3作为抑制剂,促使农作物增产。这是因为NaHSO3能抑制植物的光呼吸(消耗能量和营养),从而提高净光合作用。
4.硫(Ⅵ)的含氧化合物
(1)三氧化硫(https://www.xing528.com)
虽然S(Ⅳ)的化合物具有还原性,但要使SO2氧化为SO3却比氧化亚硫酸和亚硫酸盐慢得多。当有催化剂存在并加热时,能加速SO2的氧化反应。
![]()
气态SO3为单分子,分子中的中心S原子采取sp2杂化与3个氧原子形成σ键,成为平面正三角形,SO3(g)分子中的![]() 如图8-11所示。与此同时,中心S原子的3个电子与3个氧原子各提供的一个p电子形成一个
如图8-11所示。与此同时,中心S原子的3个电子与3个氧原子各提供的一个p电子形成一个![]() 键,垂直于杂化的σ轨道。
键,垂直于杂化的σ轨道。
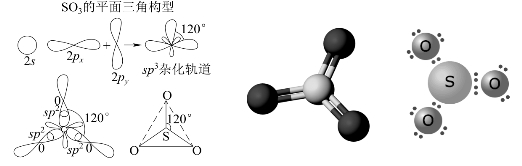
图8-11 SO3分子结构
气态SO3分子构型为平面三角形,键角∠OSO为120°,S和O之间的键长为143 pm,比S—O单键的键长(155 pm)短,所以具有双键的特征。
纯净的SO3是无色、易挥发的固体,熔点为16.3℃,沸点为44.5℃,20℃时密度为1.92 g·cm-3。SO3极易与水化合生成硫酸,同时释放出大量的热。
![]()
SO3溶于H2SO4得发烟硫酸,以H2SO4·x SO3表示其组成。发烟硫酸的试剂有含SO3 20%~25%和50%~53%两种。与SO2不同,SO3是一种强氧化剂,特别是在高温时能氧化磷、碘化物、铁、锌等金属。例如:
![]()
(2)硫酸
硫酸是重要的基本化工原料。目前我国主要是用接触法生产硫酸,其主要过程为
![]()
在H2SO4分子中,中心S原子采取sp3不等性杂化,其中2条杂化轨道与—OH中的氧原子形成2条σ键,另外2个氧原子接受硫原子的电子对形成2个σ配键,同时,这2个氧原子的2p轨道中的孤电子对进入硫原子的3d轨道形成d-pπ配键,构成=S O双键,H2SO4分子的结构如图8-12所示。
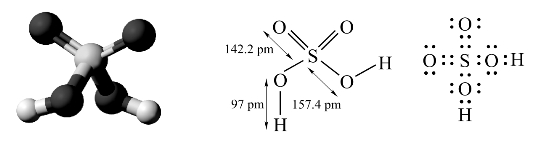
图8-12 硫酸分子结构
低温下,硫酸可结晶成晶体,由X射线衍射法测得的纯硫酸的晶体结构表明S—O和S—OH的键长不完全相等。硫酸是高沸点酸,纯H2SO4是无色油状液体,凝固点为283.36 K,沸点为611 K(质量分数为98.3%),密度为1.854 g·cm-3,相当于浓度为18 mol·dm-3。因为硫酸分子间形成氢键,所以硫酸的沸点很高,利用此性质将其与某些挥发性酸的盐共热,可以将挥发性酸置换出来。例如H2SO4是强的二元酸,在稀溶液中第一步解离是完全的,第二步解离程度则较低。
![]()

硫酸是SO3的水合物,除了硫酸H2SO4(SO3·H2O)和焦硫酸H2S2O7(2SO3·H2O)外,SO3和H2O还生成一系列的水合物,如H2SO4·H2O(SO3·2H2O)、H2SO4·2H2O(SO3·3H2O)、H2SO4·4H2O(SO3·5H2O)。这些水合物很稳定,因此浓硫酸有很强的吸水性。当它与水混合时,由于形成各种水合物而释放出大量的热,若不小心将水倾入H2SO4,将会因为产生剧热而导致爆炸。因此,在稀释硫酸时,只能在搅拌过程中把硫酸缓慢地倾入水中,绝不能把水倾入硫酸中。
由于硫酸的强氧化性和脱水性,它对动植物组织有很强的腐蚀性,如果在工作中不小心将浓硫酸洒落在皮肤上,应该立即用大量水冲洗(勿用力摩擦),然后用稀氨水浸润伤处,最后再用水冲洗,这样才不至于造成严重的灼伤。
浓硫酸是工业上和实验室中最常用的干燥剂,用来干燥不与浓硫酸起反应的各种物质,如氯气、氢气和二氧化碳等气体。浓硫酸不但能吸收游离的水,而且能从一些有机化合物中夺取与水分子组成相当的氢和氧,使这些有机物炭化,如蔗糖或纤维可被浓硫酸脱水。
![]()
因此,浓硫酸能严重地破坏动植物的组织,如损坏衣服和烧坏皮肤等,使用时必须注意安全。
稀硫酸的氧化性是由H+的氧化作用所引起的,所以只能与电位顺序在氢以前的金属如Mg、Zn、Fe等反应而放出氧气。
![]()
浓硫酸的氧化性是由H2SO4中处于最高氧化态的S(Ⅵ)所产生的。加热时,浓硫酸的氧化性更显著,它可以氧化许多金属和非金属,硫酸的还原产物一般为SO2。例如:

但金和铂在加热时也不与浓硫酸反应。此外,冷的浓硫酸不与铁、铝等金属作用,这是因为,在冷的浓硫酸中,铁、铝表面生成一层致密的保护膜,保护金属不与硫酸继续反应,这种现象称为钝化。所以,可用铁、铝器皿盛放浓硫酸。
硫酸是化学工业中一种重要的化工原料,其年产量可衡量一个国家的重化工生产能力。硫酸大部分消耗在化肥工业中,在石油、冶金等许多部门也有大量消耗。
(3)硫酸盐
硫酸是二元酸,所以能生成正盐和酸式盐两种类型的盐。在酸式盐中,只有碱金属元素(Na、K)能形成稳定的固态盐。酸式盐易溶于水,其水溶液因![]() 部分解离而使溶液显酸性。酸式盐加热脱水可生成焦硫酸盐。
部分解离而使溶液显酸性。酸式盐加热脱水可生成焦硫酸盐。
在硫酸盐中除SrSO4、BaSO4、PbSO4难溶,CaSO4、Ag2SO4微溶,其余均易溶于水。
![]()
![]()
大多数硫酸盐结晶时常带有结晶水,如CuSO4·5H2O(胆矾或蓝矾)、FeSO4·7H2O(绿矾)、ZnSO4·7H2O(皓矾)、Na2SO4·10H2O(芒硝)、MgSO4·7H2O(泻盐)等。这些结晶水在结构上并不完全相同,有些是阴离子结晶水,如CuSO4·5H2O和FeSO4·7H2O,它们的组成可以分别写成[Cu(H2O)4]2+[SO4(H2O)]2-和[Fe(H2O)6]2+[SO4(H2O)]2-,这个水合阴离子的结构一般认为是水分子通过氢键和![]() 中的氧原子相连接。
中的氧原子相连接。
许多硫酸盐有形成复盐的趋势。复盐是由两种或两种以上的简单盐类所组成的晶形化合物,常见的组成有两类:
一类的组成符合通式MⅠSO4·MⅡSO4·6H2O,式中MⅠ为![]() 、Na+、K+、Rb+、Cs+;MⅡ为Fe2+、Co2+、Ni2+、Zn2+、Cu2+、Hg2+。例如,莫尔盐(NH4)2SO4·FeSO4·6H2O、镁钾矾K2SO4·MgSO4·6H2O。
、Na+、K+、Rb+、Cs+;MⅡ为Fe2+、Co2+、Ni2+、Zn2+、Cu2+、Hg2+。例如,莫尔盐(NH4)2SO4·FeSO4·6H2O、镁钾矾K2SO4·MgSO4·6H2O。
另一类的组成符合通式MⅠSO4·M2Ⅲ(SO4)3·24H2O,式中,MⅢ为V3+、Cr3+、Fe3+、Co3+、Al3+、Ga3+等,如明矾K2SO4·Al2(SO4)3·24H2O、铬矾K2SO4·Cr2(SO4)3·24H2O。许多硫酸盐有很重要的用途。例如,Al2(SO4)3是净水剂、造纸充填剂和媒染剂,CuSO4·5H2O是消毒剂和农药,FeSO4·7H2O是农药和治疗贫血的药剂,也是制造蓝黑墨水的原料,Na2SO4·10H2O是重要的化工原料等。
由于硫酸根难被极化而变形,因此,硫酸盐均为离子晶体。硫酸盐的热稳定性和分解方式与阳离子电荷、半径以及阳离子的电子构型有关。硫酸盐受热分解的基本形式是产生金属氧化物和SO3。例如:
![]()
若金属离子有强的极化作用,其氧化物在强热时也可能进一步分解。例如

若阳离子有还原性,则可能将SO3部分还原。例如:
![]()
将SO3溶于浓硫酸时,得到组成为H2SO4·x SO3的发烟硫酸,当x=1,就形成焦硫酸H2S2O7。至今尚未制得纯的焦硫酸。它是一种无色的晶状固体,熔点为35℃。
焦硫酸也可以看成由两分子硫酸间脱去一分子水所得的产物。

焦硫酸与水反应又生成硫酸。
![]()
焦硫酸比浓硫酸有更强的氧化性、吸水性和腐蚀性。它还是良好的磺化剂,工业上用于制造某些染料、炸药和其他有机磺酸化合物。
将碱金属的硫酸氢盐加热脱水制得焦硫酸盐,再加强热就进一步分解为正盐和三氧化硫。例如:
因此,在某些实验中可用NaHSO4代替Na2S2O7。
焦硫酸盐水解后生成![]() 。由于
。由于![]() 在水中水解,因此无法配制焦硫酸盐溶液。焦硫酸盐的重要作用是熔矿作用,指将某些难溶的碱性或两性氧化物(如Fe2O3、Al2O3、Cr2O3、TiO2等)与K2S2O7或KHSO4共熔时,可使其矿物转变成可溶性硫酸盐。例如:
在水中水解,因此无法配制焦硫酸盐溶液。焦硫酸盐的重要作用是熔矿作用,指将某些难溶的碱性或两性氧化物(如Fe2O3、Al2O3、Cr2O3、TiO2等)与K2S2O7或KHSO4共熔时,可使其矿物转变成可溶性硫酸盐。例如:
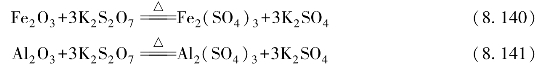
这是分析化学中处理难溶样品的一种重要方法。
5.硫代硫酸及其盐
凡含氧酸分子中的氧原子被硫原子取代而得的酸称为硫代某酸,其对应的盐称为硫代某酸盐。硫代硫酸(H2S2O3)可以看成H2SO4分子中一个氧原子被硫原子取代而得的产物,其键连关系如图8-13所示。硫代硫酸极不稳定,至今尚未制得纯的硫代硫酸,但其盐可以稳定存在,如Na2S2O3·5H2O是最重要的硫代硫酸盐。
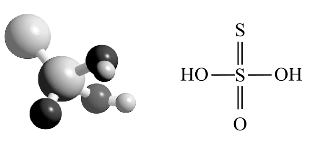
图8-13 硫代硫酸分子结构
 的构型和
的构型和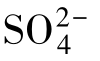 的相似,均为四面体形。
的相似,均为四面体形。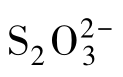 中的两个硫原子是不等价的。其中,中心S原子的氧化数为+6,另一个S原子的氧化数为-2,两个S原子的平均氧化数是+2。
中的两个硫原子是不等价的。其中,中心S原子的氧化数为+6,另一个S原子的氧化数为-2,两个S原子的平均氧化数是+2。
制备Na2S2O3的方法有两种:
一种方法是在沸腾的温度下使亚硫酸钠溶液同硫粉反应。
![]()
另一种方法是将Na2S和Na2CO3以2∶1的物质的量比配成溶液,然后通入SO2,反应大致可分三步进行。
首先,Na2CO3和SO2生成Na2SO3:
![]()
其次,Na2S和SO2作用生成Na2SO3和H2S:
![]()
H2S是强还原剂,遇到SO2时析出硫:
![]()
最后,Na2SO3与S作用生成Na2S2O3:
![]()
将上面三个反应合并,得到以下的总反应:
![]()
溶液浓缩后,冷却至293~303 K时即可析出Na2S2O3晶体。在制备Na2S2O3时,溶液必须控制在碱性范围内,否则将会有硫析出而使产品变黄。利用上述方法制得的硫代硫酸钠常含一些硫酸钠和亚硫酸钠等杂质。
市售Na2S2O3·5H2O俗称海波或大苏打。它是无色透明的晶体,易溶于水,其水溶液显弱碱性。Na2S2O3在中性溶液或碱性溶液中稳定,在酸性溶液中因为生成的硫代硫酸不稳定而分解为单质S、SO2气体和H2O。用此反应可鉴定![]() 的存在。
的存在。
![]()
硫代硫酸钠是中等强度的还原剂。
![]()
碘可将硫代硫酸钠氧化成连四硫酸钠Na2S4O6:
![]()
上述反应很重要,分析化学中的碘量法就是利用这一反应来定量测定碘。较强的氧化剂如氯、溴等,可将硫代硫酸钠氧化为硫酸钠。
![]()
因此,在纺织和造纸工业上用硫代硫酸钠作脱氯剂。
重金属的硫代硫酸盐难溶且不稳定,如Ag+和![]() 生成Ag2S2O3,在溶液中,Ag2S2O3迅速分解,由白色经黄色、棕色,最后生成黑色的Ag2S。用此法也可鉴定
生成Ag2S2O3,在溶液中,Ag2S2O3迅速分解,由白色经黄色、棕色,最后生成黑色的Ag2S。用此法也可鉴定![]() 的存在。
的存在。

硫代硫酸钠的另一个重要性质是配合性,它可与一些金属离子形成稳定的配离子,最重要的是硫代硫酸银配离子,如不溶于水的AgBr可以溶解在Na2S2O3溶液中,就是基于此种性质。
![]()
这些配合物均不稳定,遇酸分解。例如
![]()
约90%的硫代硫酸钠被用作照相业的定影液,在造纸和纺织工业中,硫代硫酸钠用于还原残留的氯漂白剂,也用于烟道气脱硫。
6.过硫酸及其盐
凡含氧酸的分子中含有过氧键的,称为过某酸。硫酸分子中含有过氧键就称为过硫酸。过硫酸也可以看成过氧化氢H—O—O—H分子中的氢原子被磺酸基(—SO3H)取代的产物。
单取代物:若H—O—O—H中一个H被![]() 取代后得H—O—O—SO3H,即H2SO5,称为过一硫酸,其键连关系如图8-14(a)所示。双取代物:另一个H也被
取代后得H—O—O—SO3H,即H2SO5,称为过一硫酸,其键连关系如图8-14(a)所示。双取代物:另一个H也被![]() 取代后,则得HSO3—O—O—SO3H,即过二硫酸,其键连关系如图8-14(b)所示。
取代后,则得HSO3—O—O—SO3H,即过二硫酸,其键连关系如图8-14(b)所示。
在过氧键—O—O—中,氧原子的氧化数是-1,而不同于其他氧原子(-2),其中硫原子的氧化数仍然是+6。通常,过二硫酸分子H2S2O8中,形式上S的氧化数为+7。
过硫酸盐如过二硫酸铵、过二硫酸钾、过二硫酸钠等都是强氧化剂,其标准电极电势为
![]()
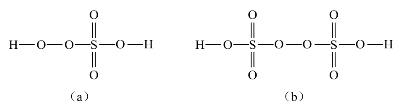
图8-14 H 2SO5和H 2S2O8的结构示意图
如,过二硫酸钾和铜的反应:
![]()
再如,过二硫酸盐在Ag+的催化作用下能将Mn2+氧化成紫红色的![]()
![]()
此反应在钢铁分析中用于锰含量的测定。过硫酸及其盐的氧化性实际上是由过氧键引起的,它们作为氧化剂参与氧化还原反应时,过氧键断裂,过氧键中两个O原子的氧化数从-1降到-2,而S的氧化数不变,仍是+6。
过二硫酸及其盐均不稳定,加热时容易分解,如K2S2O8受热会放出SO3和O2。
![]()
绝大多数过二硫酸盐(>65%)作为聚合反应的引发剂,用于生产聚丙烯腈和乳液聚合法合成聚氯乙烯等过程,其余的用于从蚀刻、印刷电路板到漂白等众多领域。
7.连二亚硫酸及其盐
H2S2O4是二元弱酸![]() 它的盐比它的酸稳定。连二亚硫酸钠(Na2S2O4·2H2O)是染料工业常用的还原剂,俗称保险粉。保险粉还原性极强,其水溶液可以吸收空气中的氧气,以保护其他物质不被氧化。
它的盐比它的酸稳定。连二亚硫酸钠(Na2S2O4·2H2O)是染料工业常用的还原剂,俗称保险粉。保险粉还原性极强,其水溶液可以吸收空气中的氧气,以保护其他物质不被氧化。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




