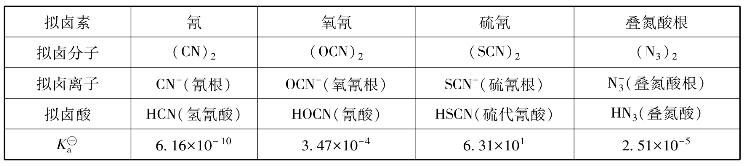
由两个或两个以上电负性较大的元素组成的负一价的阴离子,在形成离子型或共价型化合物时,表现出与卤素阴离子相似的性质,这些离子称为拟卤离子。相应的中性分子的性质也与卤素单质相似,称为拟卤素。目前已知的拟卤素有十几种,较重要的拟卤素见表8-5。
表8-5 几种重要的拟卤素
拟卤素的很多性质与卤素的具有相似性,主要表现为以下几点。
1.易挥发性
拟卤素是由两个对称的基团结合而成的共价型分子,游离状态时均有挥发性和刺激性气味。例如,(CN)2在常温常压下呈现气态,苦杏仁味,无色,可燃,剧毒。
2.氢化物的水溶液显弱酸性
除了硫代氰酸(HSCN)酸性较强外,其他酸均为弱酸,酸性均比氢卤酸的弱。酸的解离常数见表8-5。氢氰酸和氰化物均是剧毒,NaCN的致死量为0.05 g。主要是CN-与酶系统的金属作用,导致中枢神经系统瘫痪。
3.歧化反应
拟卤素在水或碱性介质中发生类似于卤素单质的歧化反应。(https://www.xing528.com)
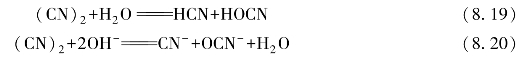
4.氧化还原性
拟卤素单质有氧化性,拟卤离子有还原性,见表8-6。
表8-6 卤素和拟卤素的标准电极电势

比较表8-6中卤素和拟卤素的标准电极电势值可知,Cl2、Br2可以氧化CN-和SCN-;(SCN)2可以氧化I-;I2可以氧化CN-。利用氰离子的强还原性,对含氰离子的水溶液进行处理,转化为无毒或低毒的产物,例如![]() 也可利用过氧化氢(H2O2)、高锰酸钾(KMnO4)溶液等处理。
也可利用过氧化氢(H2O2)、高锰酸钾(KMnO4)溶液等处理。
5.配位性
氰离子(CN-)和硫氰酸根离子(SCN-)容易与金属形成稳定的配合物。CN-的配位原子一般为金属,如[Fe(CN)6]4-、[Ag(CN)2]-等。SCN-是两可配体,与金属离子配位时可形成键合异构体,如与软酸作用时,利用其软碱部分S原子配位(形成M-SCN),称为硫氰酸根配体;与硬酸作用时,利用其硬碱部分N原子配位(形成M-NCS),称为异硫氰酸根配体。
硫氰酸盐的一个灵敏反应是与铁(Ⅲ)离子形成血红色的配合物,例如![]()
![]() ,此反应用来检验Fe3+。
,此反应用来检验Fe3+。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




