1.卤素单质的物理性质
卤素单质均为双原子分子(X2),两原子通过共价单键相连,分子间以色散力结合。随着原子序数的递增,卤素单质分子半径依次增大,相对分子质量也依次增加,色散力逐渐增大,因此,单质的熔沸点依次增高,卤素单质的存在状态呈现出由气体、液体到固体的变化规律,见表8-2。卤素单质均是易挥发的有毒物质。
表8-2 卤素单质的物理性质
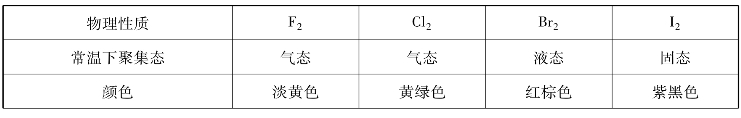
续表
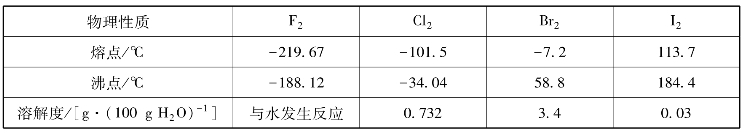
常温下,氟单质呈淡黄色气体,与水能发生剧烈的化学反应。氯单质呈黄绿色气体,易液化,工业上称为液氯,常将其储存于钢瓶中运输。氯气溶于水得到氯水,氯气易溶于CCl4、CS2等非极性溶剂。溴单质呈红棕色液体,液溴与皮肤接触会造成创伤,单质溴溶于水得到溴水,溴在水中的溶解度是卤素单质中最大的,100 g水中可溶解3.4 g溴,溴易溶于CCl4、CS2等非极性溶剂。碘单质为紫黑色固体,略带金属光泽,加热则变为紫黑色的蒸气,蒸气遇冷又重新凝聚成固体,因此利用升华法可提纯碘。碘在水中溶解度最小,难溶于水,但易溶于CCl4、CS2等非极性溶剂。利用这一性质,可以用CCl4从水中提取I2,这种方法称为CCl4萃取法,其必要的条件是CCl4和水不互溶。
虽然I2在水中溶解度小,但在KI或其他碘化物溶液中溶解度增大,而且随I-浓度增大而增大,这是由于生成了易溶于水的KI3,实验室可用此法配制I2溶液。
![]()
X2在CCl4中的颜色:F2呈无色,Cl2呈淡黄色,Br2呈橙色(或红色),I2呈紫色。而I2溶于水、KI(aq)、乙醇或乙醚中则呈棕色。
2.卤素单质的化学性质
卤素均为活泼的非金属元素,卤素单质具有强氧化性,从电极电势上看,卤素单质以氟的氧化性最强。卤素单质的氧化性次序为F2>Cl2>Br2>I2,其主要表现在与金属、非金属和水的反应。
(1)与金属反应
F2可以和所有金属直接化合,生成高氧化数氟化物。在F2与Cu、Ni、Mg作用时,由于金属表面生成一薄层致密的氟化物保护膜而终止反应,所以F2可储存在Cu、Ni、Mg或其合金容器中。
Cl2可与各种金属反应,但干燥的Cl2不与Fe反应,因此Cl2可以储存在铁罐中。
Br2和I2常温下只能与活泼金属作用,与不活泼金属在加热情况下才可以发生反应。
![]()
(2)与非金属反应
F2可与除O2、N2、He、Ne以外的所有非金属直接化合生成高价氟化物,如CF4、SF6等。大多数氟化物都具有挥发性。
Cl2也能和大多数非金属单质直接作用,但不及F2反应剧烈。产物的组成往往与Cl2的用量有关,如P在Cl2中的反应
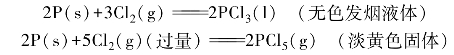
Br2和I2可以与许多非金属单质反应,但不如F2、Cl2反应剧烈,一般多形成低价化合物。例如,与P的反应,主要产物是PBr3(无色液体)和PI3(红色固体)。
X2与H2的直接化合反应,从F2到I2,越来越难,充分说明了卤素活泼性顺序。F2与H2相遇即可发生爆炸,无法控制,所以无实际意义。
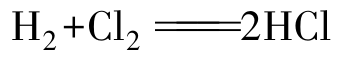 (常温反应缓慢,在加热或光照条件下发生链反应,速率相当大,爆炸)
(常温反应缓慢,在加热或光照条件下发生链反应,速率相当大,爆炸)
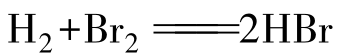 r(需加热且反应缓慢,但高温HBr不稳定,易分解)
r(需加热且反应缓慢,但高温HBr不稳定,易分解)
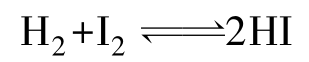 (反应在有催化剂及高温下才能进行,反应缓慢且可逆)
(反应在有催化剂及高温下才能进行,反应缓慢且可逆)
(3)与水的反应
卤素单质在水中虽然溶解度较小,但仍以溶解为主。与水可能发生以下两类反应(表8-3):

表8-3 卤素和氧的相关电对的电极电势
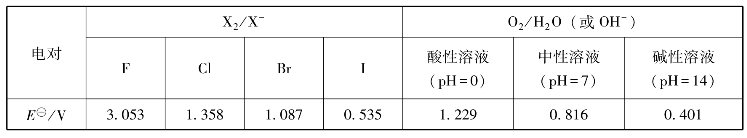
由表8-3可推断出,除碘以外,卤素均能与水按反应(8.1)进行,但反应速率不同:氟与水反应剧烈,且反应的趋势最大;氯与水反应因活化能较高,所以实际上速率很小;碘与水不反应。事实上,氯和溴与水发生第二类反应,即歧化反应。例如:
![]()
由于氟不呈正氧化态的化合物,所以它与水不发生歧化反应。其他卤素单质可发生歧化反应,且歧化反应进行的程度与溶液的pH有关,碱性条件有利于歧化反应的进行。卤素单质在碱性条件的歧化反应有两类,即
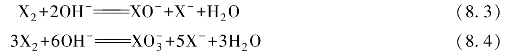 (https://www.xing528.com)
(https://www.xing528.com)
卤素单质歧化反应的产物与温度有关。常温下Cl2和低温下Br2按反应(8.3)进行。高温(>75℃)下Cl2和常温下Br2按反应(8.4)进行。I2在任何温度下均按反应(8.4)进行。卤素单质的歧化反应与介质的酸碱性相关,在酸性介质中发生逆歧化反应。
3.卤素单质的用途
随着科技的发展,氟的用途也日益广泛。如在原子能工业中,UF4和UF6用于同位素分离,为核反应堆提供燃料;SF6因具有较高的电绝缘能力而广泛应用于电力部门。氟还可作为火箭燃料的高能氧化剂、制造制冷剂(CCl2 F2)、杀虫剂(CCl3 F)、塑料单体(—F2C—CF2—)等。
氯常用于合成盐酸、药剂,用作造纸的漂白剂、饮用水的消毒剂等,在染料、炸药及塑料生产中均有广泛的应用。氯是一种重要的化工原料。
溴主要用于制造有机溴化物,这些有机溴化物可以用作农业杀虫剂、阻燃剂、汽油抗震剂的添加剂(C2H4Br2);溴还可以制造溴化银,用于照相。NaBr、KBr用作镇静剂。
碘广泛应用于医药、照相、橡胶制造等行业。为避免甲状腺疾病,可在食盐中添加少量碘化物。碘的碘化钾溶液或碘的酒精溶液具有杀菌作用,常用来处理外部创伤。
4.卤素单质的制备
卤素单质的制备方法主要有以下几种。
(1)电解法
因氟单质具有高的化学活性和氧化性,因此氟单质的制备采用电解氧化法。因为HF导电性差,所以要加入强电解质KF,常用的电解质是KHF2-HF(3∶2)的混合物。用铜或铜镍合金材料制造电解槽,石墨为阳极,钢为阴极;电解时,阳极产生氟,在阴极生成氢气。
阳极![]()
阴极![]()
总反应![]()
要注意防止F2和H2混合发生爆炸,通常在电解槽中加一隔膜将阳极生成的氟和阴极生成的氢分开。电解过程中随着HF的挥发,电解质的熔点会很快升高,需不断补充无水氟化氢,使反应继续进行。
电解法还可以制备氯和溴,但不能制备碘,这是因为析出的碘又能溶于碘化物中,形成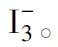
Cl2常温下加压可液化,装入钢瓶中,钢瓶表面涂绿色。
(2)氢卤酸氧化法
在工业上可用氧气(或空气)催化氧化氢卤酸的方法制备除氟以外的卤素单质。例如,在催化剂CuCl2或AlCl3的作用下制备Cl2。
![]()
实验室常用二氧化锰、高锰酸钾等氧化剂氧化浓盐酸制备氯气。
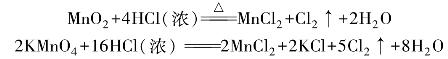
也常用氯化钠和浓硫酸来代替浓盐酸。例如
![]()
用KBr、KI代替NaCl可以制备相应的单质溴和碘。
(3)卤素间的置换反应法
工业上常用氯气通入海水或卤水中(用盐酸酸化至pH=4~5),使溴离子氧化的方法制备单质溴。
![]()
然后用空气吹出游离的Br2,并以Na2CO3吸收使发生歧化反应,生成NaBr和NaBrO3:
![]()
再用H2SO4酸化,使Br-与![]() 发生逆歧化反应,从而使Br2从溶液中重新析出。
发生逆歧化反应,从而使Br2从溶液中重新析出。
![]()
工业上也用类似方法用碘化物制备碘。例如,将氯气与藻灰的浸取液反应。
![]()
请注意,上述反应的氯气不要过量,否则会使生成的碘进一步氧化为碘酸。
![]()
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




