任何一个电极其电极电势的绝对值是无法测量的,但是我们可以选择某种电极作为基准,规定它的电极电势为零。通常选择标准氢电极(standard hydrogen electrode)作为基准。将待测电极和标准氢电极组成一个原电池,通过测定该电池的电动势(electromotive force),就可求出待测电极的电极电势的相对数值。
1.标准氢电极
标准氢电极的结构如图7-3所示。它是把表面镀上一层铂黑的铂片插入含有氢离子浓度(严格地说应为活度)为1 mol·kg-1的溶液中,并不断地通入标准压力为p⊖(即100 kPa)的纯氢气,使铂黑吸附氢气并达到饱和,这样的氢电极就是标准氢电极,规定在298.15 K时它的电极电势为0 V。在氢电极上进行的反应是
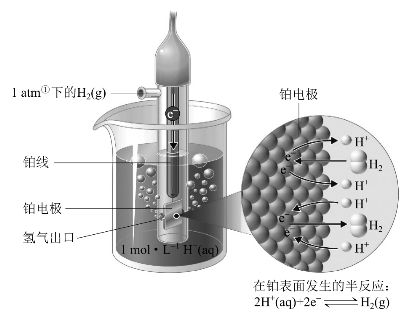
图7-3 标准氢电极
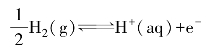
2.标准电极电势
用标准态下的各种电极与标准氢电极组成原电池,测定这些原电池的电动势就可知道这些电极的标准电极电势(standard electrode potential)。标准电极电势用符号E⊖表示。例如,用标准锌电极与标准氢电极组成原电池:
![]()
可测得电池电动势为0.761 8 V,所以锌电极的标准电极电势是-0.761 8 V。负号是因为用电表测知上述原电池中电子是从锌电极流向氢电极(电流是从氢电极流向锌电极),因此氢电极为正极,锌电极为负极。
电池电动势用符号E表示,其数值等于正电极的电极电势减去负电极的电极电势:
E=E正-E负
因为锌电极和氢电极都处于标准态,所以
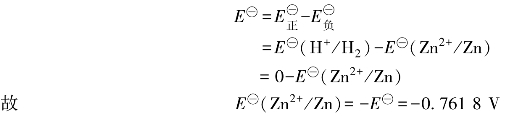
同样地,测得电池Pt|H2(p⊖)|H+(1 mol·kg-1)‖Cu2+(1 mol·kg-1)|Cu的电动势为0.341 9 V,则

 (https://www.xing528.com)
(https://www.xing528.com)
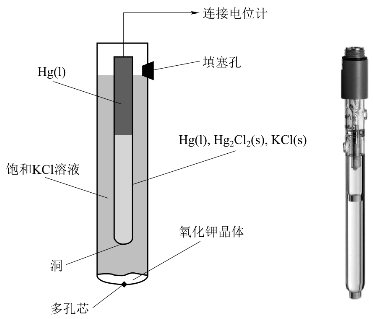
图7-4 甘汞电极构造
从理论上说,用上述方法可以测定出各种电对的标准电极电势,但是氢电极作为标准电极,使用条件十分严格,而且制作和纯化也比较复杂,因此,在实际测定时,往往采用甘汞电极(calomel electrode)作参比电极。甘汞电极在定温下电极电势数值比较稳定,并且容易制备,使用方便。甘汞电极构造如图7-4所示,它是在电极的底部放入少量汞和少量由甘汞、汞及氯化钾溶液制成的糊状物,上面充入饱和甘汞的氯化钾溶液,再用导线引出。甘汞电极的电极电位随KCl溶液浓度的不同而不同,表7-2列举了经精确测定的3种常用的甘汞电极及其电极电势值。
表7-2 三种甘汞电极的电极电势

3.标准电极电势表
许多氧化还原电对的E⊖都已测得或从理论上计算出来,将其汇列在一起便是标准电极电势表。电极电势表的编制有多种方式。常见的有两种:一种是按元素符号的英文字母顺序排列,特点是便于查阅;另一种是按电极电势数值的大小排列,或从正到负,或从负到正。其优点是便于比较电极电势的大小,有利于寻找合适的氧化剂(oxidant)或还原剂(reductant)。此外,还有按反应介质的酸碱性分成酸表和碱表编排的。表7-3采用了按电极电势从负到正的次序排列的方式。
表7-3 标准电极电势表
标准还原电势(25℃,1 mol·L-1,1 atm)

下面对该表的使用作几点说明。
•按照国际惯例,电池半反应一律用还原过程 M表示,因此,电极电势是还原电势。数值越大,说明氧化型物种获得电子的本领或氧化能力越强,即氧化性自下而上依次增强;反之,说明还原型物种失去电子的本领或还原能力越强,即还原性自上而下依次增强。
M表示,因此,电极电势是还原电势。数值越大,说明氧化型物种获得电子的本领或氧化能力越强,即氧化性自下而上依次增强;反之,说明还原型物种失去电子的本领或还原能力越强,即还原性自上而下依次增强。
•电极电势的数这种性质与物质的量无关,例如:

E⊖数值不变。
•该表为298.15 K时的标准电极电势。因为电极电势随温度的变化不大,在室温下一般均可应用表列值。
•标准电极电势是指标准态下的电极电势,即离子浓度为1 mol·kg-1,气体的分压为标准压力p⊖。如果溶液浓度不是1 mol·kg-1,那么电极电势值与标准电极电势不同。例如:

表7-3不能用于非水溶液或熔融盐。非水溶液中的电极电势之所以与水溶液中的不同,是由溶剂化作用引起的。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




