在硫酸铜溶液中放入一片锌,将发生下列氧化还原反应:
![]()
在溶液中,电子直接从锌片传递给Cu2+,使Cu2+在锌片上还原而析出金属铜,同时锌氧化为Zn2+。这个反应同时有热量放出,这是化学能转变为热能的结果。
这一反应也可在图7-1所示的装置中分开进行。在两个烧杯中,分别放入Zn(NO3)2和Cu(NO3)2溶液。在前一个烧杯中插入一根锌棒,与Zn(NO3)2溶液构成锌电极;在后一个烧杯中插入一根铜棒,与Cu(NO3)2溶液构成铜电极。用由饱和了NaCl的琼脂装入U形管中制成的盐桥(salt bridge)把两个烧杯中的溶液连通起来。当用导线把铜电极和锌电极连接起来时,检流计指针就会发生偏转,说明导线中有电流通过。这种装置能将化学能转变成为电能,称为原电池(primary cell)。

图7-1 铜锌电池示意图
在上述原电池中,锌电极上的锌失去电子变成Zn2+进入溶液,留在锌电极上的电子通过导线流到铜电极,即电子在导线中流动的方向是从锌电极流向铜电极。Cu2+在铜电极上得到电子而析出金属铜。在两电极上进行的反应分别是(https://www.xing528.com)
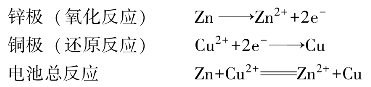
随着反应的进行,Zn2+不断进入溶液,过剩的Zn2+将使电极附近的Zn(NO3)2溶液带正电,这样就会阻止继续生成Zn2+;另外,由于铜的析出,将使铜电极附近的Cu(NO3)2溶液因Cu2+减少而带负电。这样,就会阻碍Cu的继续析出,其净结果就是没有电子继续从锌极流向铜极,而使氧化还原反应中断。盐桥的作用就是使整个装置形成一个回路,使锌盐和铜盐溶液一直维持电中性,从而使电子不断地从锌极流向铜极而产生电流。
可见,原电池的装置证明了氧化还原反应的实质是在氧化剂(Cu2+)和还原剂(Zn)之间发生了电子传递的结果。
原电池由两个半电池(half cell)组成,在上述铜锌原电池中,锌和锌盐溶液组成一个半电池,铜和铜盐溶液组成另一个半电池,两个半电池用盐桥连接。为了书写方便,在电化学中表示为
![]()
写在左边的电极是负极(negative pole)(又称为阳极,anode),起氧化反应;写在右边的电极是正极(positive pole)(又称为阴极,cathode),起还原反应。其中“|”表示液-固相界面,“‖”表示盐桥。在有气体参加的电池中,还要标明气体的压力,溶液要标明浓度。严格地说,应以质量摩尔浓度(m B)表示,本书有时也常采用物质B的浓度(c B)表示。
同一种元素不同氧化态的两种离子,如Fe3+/Fe2+、Sn4+/Sn2+等,也可以构成氧化还原电对。这类电对组成电极时,是将一种惰性电极材料如铂或石墨作为电子的载体,插在含有同种元素不同氧化态的两离子的溶液中构成的。电极符号写成Pt|Fe3+,Fe2+。气体和它的离子组成的电极也需要惰性电极材料铂或石墨等作载体。例如氢电极和氯电极,氧化还原电对是H+/H2和Cl2/Cl-,电极符号写成Pt|H2(g)|H+和Pt|Cl2(g)|Cl-。金属及金属难溶盐亦可作为电极,例如将表面涂有AgCl的银丝插在HCl溶液中,称为氯化银电极。氧化还原电对是AgCl/Ag,电极符号表示为Ag-AgCl|Cl-。这里Ag+浓度受Cl-浓度控制,因为溶液中有AgCl(s)存在,而且[Ag+][Cl-]=K sp(AgCl),因此氯化银电极和用银丝直接插入Ag+溶液中的银电极是不同的。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




